题目内容
19.把6.5gZn放入足量的稀盐酸中,锌完全反应.计算:(1)写出反应方程式并标出电子转移方向和数目.
(2)参加反应的HCl的物质的量.
(3)生成氢气的体积(标准状况).
分析 (1)锌和稀盐酸反应生成氯化锌和氢气;该反应中Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,转移电子数为2;
(2)根据锌和稀盐酸关系式计算参加反应的HCl的物质的量;
(3)根据转移电子守恒计算生成氢气体积.
解答 解:(1)锌和稀盐酸反应生成氯化锌和氢气,反应发生为 Zn+2HCl=ZnCl2+H2↑;该反应中Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,转移电子数为2,电子转移方向和数目为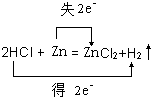 ;
;
答:反应方程式为 Zn+2HCl=ZnCl2+H2↑;电子转移方向和数目为 ;
;
(2)根据 Zn+2HCl=ZnCl2+H2↑知,参加反应的n(HCl)=2n(Zn)=2×$\frac{6.5g}{65g/mol}$=0.2mol,
答:参加反应的稀盐酸的物质的量是0.2mol;
(3)根据转移电子守恒得生成氢气体积=$\frac{\frac{6.5g}{65g/mol}×2}{2}×22.4L/mol$=2.24L,
答:生成氢气体积是2.24L.
点评 本题考查化学反应方程式有关计算,为高频考点,侧重考查学生分析计算能力,易错点是标电子转移方向和数目,注意转移电子守恒的灵活运用,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
7.下列有关氢气与氯气反应的叙述中,不正确的是( )
| A. | 纯净的氢气在氯气里安静地燃烧,发出苍白色火焰 | |
| B. | 氢气与氯气反应生成的氯化氢气体与空气里的水蒸气结合,呈白雾状 | |
| C. | 氢气与氯气混合后,光照发生爆炸 | |
| D. | 氢气与氯气的反应是化合反应,是氧化还原反应,且有电子得失 |
14.下列说法正确的是( )
| A. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |

 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少;甲池中发生的反应为:CH4+2O2+2KOH═K2CO3+3H2O.回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少;甲池中发生的反应为:CH4+2O2+2KOH═K2CO3+3H2O.回答下列问题: 名称是3,5-二甲基庚烷.
名称是3,5-二甲基庚烷. 名称是1,2-二甲苯.
名称是1,2-二甲苯. 名称是5,5-二甲基-2-己炔.
名称是5,5-二甲基-2-己炔. 名称是4-甲基-1-戊烯.
名称是4-甲基-1-戊烯.