题目内容
2.下列各组中每种物质都既有离子键又有共价键的一组是( )| A. | NaOH、H2SO4、(NH4)2SO4 | B. | Ba(OH)2、Na2SO4、Na3PO4 | ||
| C. | Na2CO3、HNO3、MgO | D. | HCl、Al2O3、MgCl2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族金属元素、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,含有铵根离子的盐中含有离子键,据此分析解答.
解答 解:A.硫酸中只含共价键,故A错误;
B.这三种物质中都含有离子键和共价键,故B正确;
C.硝酸中只含共价键、MgO中只含离子键,故C错误;
D.HCl中只含共价键、氧化铝中只含离子键、氯化镁中只含离子键,故D错误;
故选B.
点评 本题考查化学键判断,为高频考点,明确离子键和共价键根本区别及基本概念是解本题关键,注意:不能根据是否含有金属元素判断离子键,如铵盐中不含金属元素但含有离子键,氯化镁中两个氯离子之间不存在化学键,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
12.下列关于有机物的叙述中
①乙烯、聚氯乙烯和苯分子中均含有碳碳双键
②苯、油脂均不能使酸性KMnO4溶液褪色
③氯苯分子中所有原子都处于同一平面
④甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种.
⑤一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
⑥
⑦一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g
其中全部不正确的是( )
①乙烯、聚氯乙烯和苯分子中均含有碳碳双键
②苯、油脂均不能使酸性KMnO4溶液褪色
③氯苯分子中所有原子都处于同一平面
④甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种.
⑤一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
⑥

⑦一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g
其中全部不正确的是( )
| A. | ①③⑥⑦ | B. | ③④⑤⑥ | C. | ①②④⑤ | D. | ①⑤⑥⑦ |
10.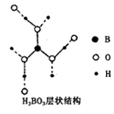 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )| A. | 含1 mol H3BO3的晶体中有6 mol氢键 | |
| B. | 分子中硼原子、氧原子最外层均为8e-的稳定结构 | |
| C. | 正硼酸晶体属于原子晶体 | |
| D. | H3BO3分子的稳定性与氢键无关 |
17.下列各组物质中,能用高锰酸钾酸性溶液鉴别的是( )
| A. | 乙烯、乙炔 | B. | 1-己烯、苯 | C. | 苯、正已烷 | D. | 甲苯、2-己烯 |
14.“类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论中正确的( )
| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第3周期元素氢化物的稳定性顺 序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4,则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | NCl3中N原子是sp3杂化,则BCl3中B原子也是sp3杂化 | |
| D. | 干冰CO2是分子晶体,则SiO2也是分子晶体 |
11.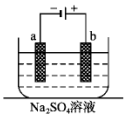 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )| A. | 电子的流向:负极→a电极→b电极→正极 | |
| B. | a电极附近呈蓝色,b电极附近呈红色 | |
| C. | 逸出气体的体积,a电极的大于b电极的 | |
| D. | Na+向a极移动 |
7.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
回答下列问题:
(1)③的元素符号是Li;⑧的元素名称是硼;①在元素周期表中的位置是(周期、族)第二周期第VIA族;其氢化物的电子式是: .
.
(2)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(3)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
| 编号 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li;⑧的元素名称是硼;①在元素周期表中的位置是(周期、族)第二周期第VIA族;其氢化物的电子式是:
 .
.(2)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(3)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
 A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.
A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.