题目内容
14.“类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论中正确的( )| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第3周期元素氢化物的稳定性顺 序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4,则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | NCl3中N原子是sp3杂化,则BCl3中B原子也是sp3杂化 | |
| D. | 干冰CO2是分子晶体,则SiO2也是分子晶体 |
分析 A.元素的非金属性越强,其氢化物的稳定性越强,同一周期从左向右,元素的非金属性逐渐增强;
B.分子的相对分子质量越大,分子间作用力越大,氢化物的沸点越高,分子间含有氢键的晶体熔沸点较高;
C.根据价电子对互斥理论确定,NCl3中N原子是sp3杂化,三氯化硼中的硼为sp2杂化;
D.干冰CO2是分子晶体,SiO2是原子晶体.
解答 解:A.同一周期从左向右,元素的非金属性逐渐增强,第2周期元素非金属性F>O>N,第3周期元素非金属性Cl>S>P,元素的非金属性越强,其氢化物的稳定性越强,第2周期元素氢化物的稳定性顺序是HF>H2O>NH3,第3周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3,故A正确;
B.分子的相对分子质量越大,分子间作用力越大,氢化物的沸点越高,ⅣA族氢化物的沸点大小顺序为GeH4>SiH4>CH4,含有氢键的熔沸点较高,氨气中含有氢键,则沸点:PH3<AsH3<NH3,故B错误;
C.NCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3×1}{2}$=4,所以原子杂化方式是sp3,BCl3分子中B原子价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3且不含孤电子对,所以B原子采用sp2杂化,故C错误;
D.干冰是由二氧化碳分子之间通过范德华力结合构成的分子晶体,二氧化硅是由硅原子和氧原子按照个数比1:2通过Si-O键构成原子晶体,故D错误;
故选A.
点评 本题考查迁移类推思想的应用,为高频考点,明确同一周期、同一主族元素原子结构和元素周期律关系知道非金属性、金属性强弱比较方法是解本题关键,注意氢化物的熔沸点与氢键有关,题目难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
4.下列物质中属于共价化合物的是( )
| A. | NH4Cl | B. | CuSO4 | C. | CO2 | D. | Br2 |
5.现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生,Y溶解;②把Z、W用导线连接后同时浸入稀硫酸溶液中,W发生还原反应;③把X、Z用导线连接后同时浸入稀硫酸溶液中,电子流动方向为X→导线→Z.根据上述情况判断正确的是( )
| A. | 在①中金属片Y发生还原反应 | |
| B. | 在②中金属片W作负极 | |
| C. | 上述四种金属的活动性顺序为W<X<Z<Y | |
| D. | 如果把Y、W用导线相连后同时浸入稀硫酸溶液,则电子流动方向为Y→导线→W |
2.下列各组中每种物质都既有离子键又有共价键的一组是( )
| A. | NaOH、H2SO4、(NH4)2SO4 | B. | Ba(OH)2、Na2SO4、Na3PO4 | ||
| C. | Na2CO3、HNO3、MgO | D. | HCl、Al2O3、MgCl2 |
9.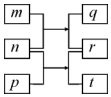 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一元强酸,t通常是固态单质.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W>X>Y | B. | 元素的非金属性Z>X>Y | ||
| C. | X的氢化物常温常压下为液态 | D. | Y的最高价氧化物的水化物为弱酸 |
19.判断下列元素中不属于主族元素的是( )
| A. | 硫 | B. | 铁 | C. | 钙 | D. | 硅 |
6.下列事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Cu>Na | |
| C. | 酸性H2CO3<H2SO4,判断硫与碳的非金属性强弱:S>C | |
| D. | F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl |
3.表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | L2+与R2-的核外电子数相等 | |
| D. | 单质分别与浓度相等的稀盐酸反应的速率为Q>L |