题目内容
A、B、C、D、E是原子序数依次增大的短周期主族元素.其中A能够形成电性不同的两种单核离子,B的每层电子均为其所在电子层序数的两倍,C的最高价氧化物的水化物的溶液呈强碱性,C和D的最外层电子数之和等于B的最外层电子数,A和E形成化合物的空间结构呈直线形.
(1)B的名称为 ,其中金属元素的金属性由强到弱的顺序为 .
(2)由以上三种元素构成的气态物质的分子式 .
(3)A与B形成的化合物中,分子结构为正四面体形的分子式为 ,分子结构呈直线形的结构式为 .
(4)C和D都能与E形成化合物,则其熔点从高到低的顺序为 (用化学式表示).
(5)D的某种化合物、E的单质分别用于自来水的净化、消毒.则与净化相关的离子方程式为 ,与消毒直接相关的物质的电子式为 .
(1)B的名称为
(2)由以上三种元素构成的气态物质的分子式
(3)A与B形成的化合物中,分子结构为正四面体形的分子式为
(4)C和D都能与E形成化合物,则其熔点从高到低的顺序为
(5)D的某种化合物、E的单质分别用于自来水的净化、消毒.则与净化相关的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是原子序数依次增大的短周期主族元素.其中A能够形成电性不同的两种单核离子,则A为H元素;B的每层电子均为其所在电子层序数的两倍,则B原子只能有2个电子层,最外层电子数为4,故B为C元素;C的最高价氧化物的水化物的溶液呈强碱性,则C为Na;C和D的最外层电子数之和等于B的最外层电子数,则D原子最外层电子数=4-1=3,结合原子序数可知D为Al;A和E形成化合物的空间结构呈直线形,E的原子序数大于Al,则E为Cl元素,据此解答.
解答:
解:A、B、C、D、E是原子序数依次增大的短周期主族元素.其中A能够形成电性不同的两种单核离子,则A为H元素;B的每层电子均为其所在电子层序数的两倍,则B原子只能有2个电子层,最外层电子数为4,故B为C元素;C的最高价氧化物的水化物的溶液呈强碱性,则C为Na;C和D的最外层电子数之和等于B的最外层电子数,则D原子最外层电子数=4-1=3,结合原子序数可知D为Al;A和E形成化合物的空间结构呈直线形,E的原子序数大于Al,则E为Cl元素,
(1)由上述分析可知,B为碳元素,同周期随原子序数增大金属性减弱,故金属性Na>Al,故答案为:碳;Na>Al;
(2)由以上三种元素构成的气态物质的分子式为:CH3Cl,故答案为:CH3Cl;
(3)H与C元素形成的化合物中,分子结构为正四面体形的分子式为CH4,分子结构呈直线形的为乙炔,其结构式为H-C≡C-H,故答案为:CH4;H-C≡C-H;
(4)Na和Al与Cl形成化合物分别为NaCl、AlCl3,前者属于离子晶体,后者属于分子晶体,故NaCl熔点较高,故答案为:NaCl>AlCl3;
(5)铝盐溶液中Al3+离子水解:Al3++3H2O?Al(OH)3(胶体)+3H+,生成氢氧化铝胶体可以吸附吸附物质,可以用于自来水的净化,Cl2与水反应生成HClO,HClO具有强氧化性,可以用于消毒,其电子式为: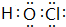 ,
,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;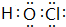 .
.
(1)由上述分析可知,B为碳元素,同周期随原子序数增大金属性减弱,故金属性Na>Al,故答案为:碳;Na>Al;
(2)由以上三种元素构成的气态物质的分子式为:CH3Cl,故答案为:CH3Cl;
(3)H与C元素形成的化合物中,分子结构为正四面体形的分子式为CH4,分子结构呈直线形的为乙炔,其结构式为H-C≡C-H,故答案为:CH4;H-C≡C-H;
(4)Na和Al与Cl形成化合物分别为NaCl、AlCl3,前者属于离子晶体,后者属于分子晶体,故NaCl熔点较高,故答案为:NaCl>AlCl3;
(5)铝盐溶液中Al3+离子水解:Al3++3H2O?Al(OH)3(胶体)+3H+,生成氢氧化铝胶体可以吸附吸附物质,可以用于自来水的净化,Cl2与水反应生成HClO,HClO具有强氧化性,可以用于消毒,其电子式为:
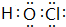 ,
,故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
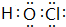 .
.
点评:本题考查结构性质位置关系的应用,推断元素是解题关键,(5)为易错点,离子方程式书写中学生容易忽略备注胶体,HClO电子式书写中容易受化学式影响.

练习册系列答案
相关题目
下列4个化学反应中,与其他3个反应类型不同的是( )
A、CH3CHO+2Cu(OH)2
| |||
B、CH3CH2OH+CuO
| |||
C、2CH2═CH2+O2
| |||
| D、CH3CH2OH+HBr-→CH3CH2Br+H2O |
能用H++OH-=H2O表示的是( )
| A、NaOH溶液和醋酸的反应 |
| B、Ba(OH)2溶液和稀H2SO4的反应 |
| C、KOH溶液和盐酸反应 |
| D、NaHCO3和NaOH的反应 |
欲配制100ml 1.0mol/L NaOH溶液,正确的方法是( )
①将4.0gNaOH溶于100ml水中
②将4.0gNaOH溶于少量水中,再用水稀释至100ml
③将20ml 5.0mol/LNaOH溶液用水稀释至100ml.
①将4.0gNaOH溶于100ml水中
②将4.0gNaOH溶于少量水中,再用水稀释至100ml
③将20ml 5.0mol/LNaOH溶液用水稀释至100ml.
| A、①② | B、②③ | C、①③ | D、①②③ |
为证明某可溶性一元酸(HX)是弱酸,有如下实验方案.其中不合理的是( )
| A、室温下,测0.1mol/L的HX溶液的pH,若pH>1,证明HX是弱酸 |
| B、室温下,测0.1mol/L的NaX溶液的pH,若pH>7,证明HX是弱酸 |
| C、相同条件下,对0.1mol/L的HCl和0.1mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX是弱酸 |
| D、将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
25℃的四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.有关上述溶液的比较中,正确的是( )
| A、水电离的c(H+):①=②=③=④ |
| B、将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>①>② |
常温下,在下列溶液中一定能大量共存的离子组是( )
| A、FeSO4溶液中:K+、H+、Cl-、NO3- |
| B、c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl- |
| C、使甲基橙变黄的溶液中:Na+、K+、SO42-、AlO2- |
| D、和铝反应产生氢气的溶液中:K+、Ba2+、NO3-、HCO3- |
