题目内容
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:
(1)Z基态原子的核外电子排布式是 ;
(2)X、Y可组成一化合物,其原子个数之比为5:1.其化学式中含有的化学键有 .
(3)YX3分子的空间构型是 ,中心原子的杂化方式是 ;Y的氢化物的沸点比W的氢化物的沸点 (填“高”或“低”).
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z2W2的电子式为 .
(1)Z基态原子的核外电子排布式是
(2)X、Y可组成一化合物,其原子个数之比为5:1.其化学式中含有的化学键有
(3)YX3分子的空间构型是
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z2W2的电子式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W四种短周期元素的原子序数依次增大,Y的最高价氧化物对应的水化物与其氢化物反应生成盐,则Y应为N元素;X的原子序数小于N元素,与N元素形成的常见化合物为气体,则X为H元素;Y的核电荷数为7,与W的最外层电子数相同,W处于ⅦA族,Z的原子序数小于W,周期表中W与Z左右相邻,则Z处于ⅥA族,H元素与Z、W所形成的常见化合物在常温下均呈气态,则Z为S元素、W为Cl元素,据此解答.
解答:
解:X、Y、Z、W四种短周期元素的原子序数依次增大,Y的最高价氧化物对应的水化物与其氢化物反应生成盐,则Y应为N元素;X的原子序数小于N元素,与N元素形成的常见化合物为气体,则X为H元素;Y的核电荷数为7,与W的最外层电子数相同,W处于ⅦA族,Z的原子序数小于W,周期表中W与Z左右相邻,则Z处于ⅥA族,H元素与Z、W所形成的常见化合物在常温下均呈气态,则Z为S元素、W为Cl元素,
(1)Z为S元素,原子核外电子排布式为:1s22s22p63s23p4,
故答案为:1s22s22p63s23p4;
(2)H、N可组成一化合物,其原子个数之比为5:1,该化合物为NH4H,属于离子化合物,含有离子键,铵根离子中含有极性键、配位键,
故答案为:离子键、极性键、配位键;
(3)YX3为NH3,空间结构为三角锥形,中心N原子成3个σ键、含有1对孤对电子,杂化轨道数目为4,采取sp3杂化,氨气分子之间存在氢键,其沸点比HCl的沸点高,
故答案为:三角锥形;sp3杂化;高;
(4)S2Cl2分子中,Cl与S均满足8e-稳定结构,S原子之间形成1对共用电子对、每个S原子与Cl原子之间形成1对共用电子对,其电子式为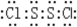 ,
,
故答案为: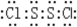 .
.
(1)Z为S元素,原子核外电子排布式为:1s22s22p63s23p4,
故答案为:1s22s22p63s23p4;
(2)H、N可组成一化合物,其原子个数之比为5:1,该化合物为NH4H,属于离子化合物,含有离子键,铵根离子中含有极性键、配位键,
故答案为:离子键、极性键、配位键;
(3)YX3为NH3,空间结构为三角锥形,中心N原子成3个σ键、含有1对孤对电子,杂化轨道数目为4,采取sp3杂化,氨气分子之间存在氢键,其沸点比HCl的沸点高,
故答案为:三角锥形;sp3杂化;高;
(4)S2Cl2分子中,Cl与S均满足8e-稳定结构,S原子之间形成1对共用电子对、每个S原子与Cl原子之间形成1对共用电子对,其电子式为
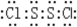 ,
,故答案为:
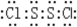 .
.
点评:本题考查结构性质位置关系应用,涉及核外电子排布、化学键、分子结构与性质、杂化轨道、电子式等,题目难度中等.

练习册系列答案
相关题目
常温下0.1mol?L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
①将溶液稀释到原体积的10倍 ②升温 ③加锌粒 ④加入适量的NaOH固体 ⑤加Na2SO4溶液
⑥加入适量的醋酸钠固体 ⑦加NaHSO3 固体 ⑧加入等体积0.2mol?L-1盐酸.
①将溶液稀释到原体积的10倍 ②升温 ③加锌粒 ④加入适量的NaOH固体 ⑤加Na2SO4溶液
⑥加入适量的醋酸钠固体 ⑦加NaHSO3 固体 ⑧加入等体积0.2mol?L-1盐酸.
| A、①②④⑧ | B、③④⑤⑥ |
| C、③④⑥⑧ | D、①④⑤⑥⑦ |
下列叙述正确的是( )
| A、微粒abXn-中中子数为b-a-n | ||||
B、反应SiO2+3C
| ||||
| C、非金属氧化物一定属于非电解质 | ||||
| D、金属氧化物可能属于酸性氧化物 |
 如图为A、B、C、D四种物质的转化关系,a、b为反应条件,
如图为A、B、C、D四种物质的转化关系,a、b为反应条件, 下表是长式周期表的一部分,其中的编号代表对应的元素.
下表是长式周期表的一部分,其中的编号代表对应的元素.