题目内容
20.某同学根据H2S和浓H2SO4的性质做出下列推测,其中正确的是( )| A. | 浓H2SO4具有强氧化性是因为其中含+6价S,所有只要含最高价+6价S的化合物就具有强氧化性 | |
| B. | H2S中的S处于最低价,因此其不可能具有氧化性 | |
| C. | 浓H2SO4可把Na2SO3氧化 | |
| D. | 因为元素化合价变化以相邻价态之间转化最容易,因此发生氧化还原反应时,浓H2SO4对应的产物一般为SO2 |
分析 A.稀硫酸不具有强氧化性;
B.H2S中的S处于最低价,H为+1价,具有氧化性;
C.浓H2SO4与Na2SO3不发生氧化还原反应;
D.根据S的化合价有-2、0、+4、+6价判断.
解答 解:A.浓H2SO4为氧化性酸,具有强氧化性,但稀硫酸不具有强氧化性,故A错误;
B.H2S中H为+1价,具有氧化性,故B错误;
C.浓H2SO4与Na2SO3中S的化合价分别为+6价、+4价,无中间价态,不能发生氧化还原反应,故C错误;
D.S的化合价有-2、0、+4、+6价,因为元素化合价变化以相邻价态之间转化最容易,因此发生氧化还原反应时,浓H2SO4的S元素化合价为+6价,易变化为+4价,即产物一般为SO2,故D正确.
故选D.
点评 本题以硫化氢、硫酸为载体考查氧化还原反应,明确S元素化合价变化对应关系是解本题关键,发生氧化还原反应时元素化合价变化不能交叉发生,为易错点,注意把握浓硫酸的性质,难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
9.常温下,向NH4Cl溶液中通入一定量的NH3,使溶液呈中性,对此溶液说法中,正确的是( )
| A. | c(Cl-)=c(NH4+) | B. | NH4+水解程度增大 | ||
| C. | 氨水电离程度增大 | D. | 溶液中有少量NH4Cl存在 |
8.下列说法正确的是( )
| A. | 500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
15.检验牙膏中是否含有甘油选用的试剂是( )
| A. | 氢氧化钠溶液 | B. | 氢氧化铜浊液 | C. | 醋酸溶液 | D. | 碳酸钠溶液 |
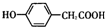 ;写出A与NaHCO3溶液反应的化学方程式
;写出A与NaHCO3溶液反应的化学方程式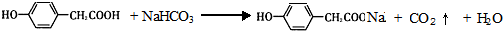 .
.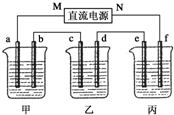 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.