题目内容
20.某化学课外小组以海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验可分解为如下各步:A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗上口倒出上层溶液;
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗口上的小孔;
H.静置、分层.
就此实验完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):C→B→D→A→H→G→E→F
(2)D步骤为什么要不时旋开活塞放气?防止分液漏斗内压强过大而发生危险.
(3)上述E步骤的操作中应注意使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出.
(4)上述G步骤操作的目的是使漏斗内外空气相通,以保证漏斗里液体能够流出.
(5)能选用CCl4从碘水中萃取碘的原因是CCl4与水不互溶;而且碘在CCl4中的溶解度比在水中的大得多.
分析 CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,
(1)操作为查漏→装液→振荡→静置→分液;
(2)倒转漏斗振荡,并不时旋开活塞放气,防止分液漏斗内压强过大;
(3)旋开活塞,分离下层液体;(G)步骤可使液体顺利流下;
(4)将分液漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗口上的小孔是保持内外压强相同,便于液体流下;
(5)碘在水、四氯化碳中的溶解性不同.
解答 解:(1)操作为查漏→装液→振荡→静置→分液,则步骤为C→B→D→A→H→G→E→F;
故答案为:C;B;D;G;
(2)D步骤为什么要不时旋开活塞放气,防止分液漏斗内压强过大而发生危险,
故答案为:防止分液漏斗内压强过大而发生危险;
(3)旋开活塞,分离下层液体,应使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出,
故答案为:使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;
(4)(G)步骤操作的目的是为了使漏斗内外空气相通,以保证进行液体顺利流出.
故答案为:使漏斗内外空气相通,以保证漏斗里液体能够流出;
(5)选用CCl4从碘水中萃取碘的原因是CCl4与水不互溶;而且碘在CCl4中的溶解度比在水中的大得多;
故答案为:CCl4与水不互溶;而且碘在CCl4中的溶解度比在水中的大得多.
点评 本题考查了蒸馏与分液的有关实验操作问题,注意实验操作的步骤、实验步骤的理解应用,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列有关有机物的叙述不正确的是( )
| A. | C5H12O的醇有8种结构 | B. | 分子式为C4H8的链烃有2种 | ||
| C. | C4H8O2的酯有4种结构 | D. | C9H12含苯环的烃有8种 |
11.下列说法中,正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物的物质的量的减少或任何一种生成物物质的量的增加 | |
| B. | 化学反应速率为0.8mol•L-1•s-1是指1秒钟时某物质的浓度为0.8mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 |
5.在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)△H<0,下列条件能加快反应速率的是( )
| A. | 体积不变,向其中加入1mol H2 | |
| B. | 体积不变,向其中加入1mol N2 | |
| C. | 压强不变,向其中加入1mol N2 | |
| D. | 压强不变,向其中加入1mol H2和1molI2 |
9.下列反应中,不属于取代反应的是( )
| A. | 苯与液溴在FeBr3催化作用下生成溴苯的反应 | |
| B. | 丙烯和氯气在一定条件下反应生成ClCH2CH=CH2 | |
| C. | 乙酸与乙醇生成乙酸乙酯的反应 | |
| D. | 乙烯与HCl气体反应生成一氯乙烷的反应 |
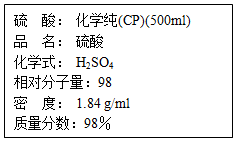 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: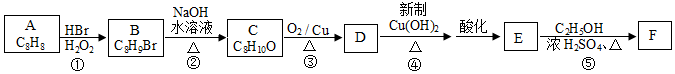
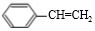 .
.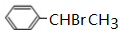 .
.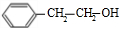 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2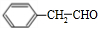 +2H2O、
+2H2O、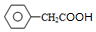 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$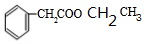 +H2O.
+H2O.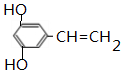 .
.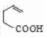 制备
制备 的合成路线.
的合成路线.