题目内容
4.下图所示的实验操作,不能达到相应目的是( )| A. |  干燥Cl2 | B. |  检验K2CO3中的K+ | ||
| C. |  证明HCl极易溶于水 | D. |  实验室制氨气 |
分析 A.干燥气体时导管长进短出;
B.观察K的焰色反应透过蓝色的钴玻璃;
C.HCl极易溶于水,内压小于外压;
D.收集的氨气的试管口应塞一团棉花.
解答 解:A.干燥气体时导管长进短出,则实验装置不能干燥氯气,故A错误;
B.观察K的焰色反应透过蓝色的钴玻璃,则图中操作可观察,故B正确;
C.HCl极易溶于水,内压小于外压,气球变大,则图中装置可证明HCl极易溶于水,故C正确;
D.收集的氨气的试管口应塞一团棉花,图中装置可制备氨气,故D正确;
故A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、气体的制备及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
19.现有下列十种物质:
①H2②铝③CaO④CO2⑤H2SO4 ⑥Ba(OH)2⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-,
(4)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4gAl发生反应时,转移电子的物质的量为0.6mol.该反应的离子方程式为Al+4H++NO3-=Al3++NO↑+2H2O.
(6)白色沉淀变成灰绿色再变成红褐色沉淀的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
①H2②铝③CaO④CO2⑤H2SO4 ⑥Ba(OH)2⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-,
(4)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4gAl发生反应时,转移电子的物质的量为0.6mol.该反应的离子方程式为Al+4H++NO3-=Al3++NO↑+2H2O.
(6)白色沉淀变成灰绿色再变成红褐色沉淀的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
9.下列关于反应H2(g)+I2(g)?2HI(g)的平衡常数K的说法中,正确的是( )
| A. | 在任何条件下,化学平衡常数是一个恒定量 | |
| B. | 改变反应物浓度或生成物浓度都会改变平衡常数K | |
| C. | 从平衡常数K的大小不能推断一个反应进行的程度 | |
| D. | 平衡常数K只与温度有关,与反应物的浓度无关 |
16.下列有关物质用途的说法正确的是( )
| A. | 氯气可用于自来水消毒 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 碳酸钠可用来治疗胃酸过多 | D. | 铝制容器可长期存放碱性物质 |
14.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性.下列说法正确的是( )
| A. | A、B、C三种元素形成的化合物中肯定只含共价键 | |
| B. | A、C形成的化合物中只有A-C键 | |
| C. | 工业上生产单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
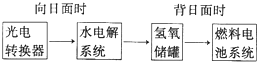

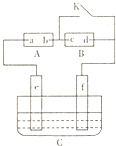 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
 ;其反应类型是消去反应.
;其反应类型是消去反应.