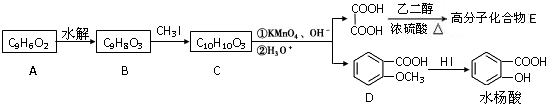
题目内容
现使用酸碱中和滴定法测定某浓度的盐酸.
I.实验步骤:
(1)将原有的盐酸稀释10倍:用滴定管量取10.00mL原有的盐酸,在 (填仪器名称 )中用水稀释、冷却后转移到 (填仪器名称)中定容,摇匀即得待测盐酸.
(2)用滴定管取待测盐酸20.00mL于锥形瓶中,向其中滴加2滴 作指示剂.
(3)读取盛装0.2500mol/L NaOH溶液的滴定管的初始读数为0.70mL
(4)滴定,当锥形瓶中溶液的颜色由 色变为 色.且 时,即到达滴定终点,则此时滴定管的读数为19.60mL
Ⅱ.实验结果:原有的盐酸浓度为 mol/L.
Ⅲ.误差分析:下列操作会使实验结果偏大的是 (不止一个正确答案).
a.滴定管在滴定时未用标准NaOH溶液润洗
b.滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测盐酸后,再加入少量水
d..锥形瓶在滴定时剧烈摇动,有少量液体溅出.
I.实验步骤:
(1)将原有的盐酸稀释10倍:用滴定管量取10.00mL原有的盐酸,在
(2)用滴定管取待测盐酸20.00mL于锥形瓶中,向其中滴加2滴
(3)读取盛装0.2500mol/L NaOH溶液的滴定管的初始读数为0.70mL
(4)滴定,当锥形瓶中溶液的颜色由
Ⅱ.实验结果:原有的盐酸浓度为
Ⅲ.误差分析:下列操作会使实验结果偏大的是
a.滴定管在滴定时未用标准NaOH溶液润洗
b.滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测盐酸后,再加入少量水
d..锥形瓶在滴定时剧烈摇动,有少量液体溅出.
考点:中和滴定
专题:实验题
分析:Ⅰ、(1)溶液的定容在对应体积的容量瓶中进行;
(2)强碱滴定弱酸时应选择碱性变色范围内的指示剂酚酞;
(3)滴定终点时溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅱ、中和20.00mL盐酸需用NaOH溶液19.60mL-0.70mL=18.90mL,所以中和100mL盐酸需用NaOH溶液18.90mL×5=94.5mL,据c(待测)=
计算;
Ⅲ、看错误操作导致V(标准)的变化,据c(待测)=
分析误差.
(2)强碱滴定弱酸时应选择碱性变色范围内的指示剂酚酞;
(3)滴定终点时溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅱ、中和20.00mL盐酸需用NaOH溶液19.60mL-0.70mL=18.90mL,所以中和100mL盐酸需用NaOH溶液18.90mL×5=94.5mL,据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
Ⅲ、看错误操作导致V(标准)的变化,据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:
解:Ⅰ.(1)用滴定管(或10mL移液管)(量取10.00mL盐酸,在烧杯中用水稀释后转移到100mL 容量瓶中定容,摇匀即得待测盐酸溶液,
故答案为:烧杯;100mL容量瓶;
(2)盐酸与NaOH反应生成了强碱强酸盐,溶液呈中性,应选择变色明显的指示剂酚酞,
故答案为:酚酞;
(3)NaOH滴定盐酸的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色,
故答案为:无;红;半分钟内不褪色;
Ⅱ、c(待测)=
=
=2.363mol/L,故答案为:2.363;
Ⅲ、a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=
分析可知c(待测)偏大,故a正确;
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
分析可知c(待测)偏大,故b正确;
c.锥形瓶中加入待测盐酸溶液后,再加少量水,对V(标准)无影响,根据c(待测)=
分析可知c(待测)不变,故c错误;
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=
分析可知c(待测)偏小,故d错误;
故答案为:ab.
故答案为:烧杯;100mL容量瓶;
(2)盐酸与NaOH反应生成了强碱强酸盐,溶液呈中性,应选择变色明显的指示剂酚酞,
故答案为:酚酞;
(3)NaOH滴定盐酸的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色,
故答案为:无;红;半分钟内不褪色;
Ⅱ、c(待测)=
| c(标准)×V(标准) |
| V(待测) |
| 0.0945L×0.2500mol/L |
| 0.010L |
Ⅲ、a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
c.锥形瓶中加入待测盐酸溶液后,再加少量水,对V(标准)无影响,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故答案为:ab.
点评:本题主要考查了中和滴定操作,难度不大,只要掌握对应知识即可完成,注意根据浓度公式分析误差.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
X是铁与硫在隔绝空气的条件下反应后所得固体,倾斜A使稀硫酸(足量)与固体X充分反应,等反应停止后,B装置质量增加,C装置中溶液无变化.反应后进入量气管气体的体积VmL(已折算成标准状况),下列说法正确的是( )
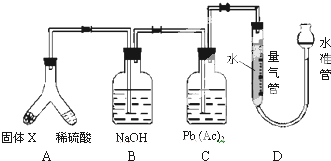

| A、固体X中一定有的物质是FeS、Fe 和S |
| B、B装置中的溶质一定是Na2S |
| C、C装置的作用是检验H2S是否完全被吸收 |
| D、X中其中一种物质的质量为V/400g |
下列有关化学反应中能量变化的叙述错误的是( )
| A、已知2H2(g+O2(g)=2H2O(g)△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| B、稀氢氧化钠溶液与稀盐酸溶液中和,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、需要加热才能发生的反应不一定是吸热反应 |
2011年3月28日,兰州某大学一实验室的实验装置发生爆炸并引起火灾.由此可见,注意安全措施非常重要.下列说法不正确的是( )
| A、做化学实验期间必须穿长袖、过膝的衣服,不准穿拖鞋,长发(过衣领)必须扎短或藏于帽内 |
| B、皮肤上不慎沾上浓硫酸要立即用氢氧化钠溶液冲洗 |
| C、绝对禁止向燃着的酒精灯里添加酒精 |
| D、熟悉常见危险化学品标志和污染物、废弃物的处理方法 |
某小分子化合物含有C、H、O、N四种元素,该有机物可能是( )
| A、氨基酸 | B、油脂 |
| C、蛋白质 | D、葡萄糖 |
蔗糖3.42g与麦芽糖3.42g混合后并完全水解,若生成m个葡萄糖分子与n 个果糖分子,则m与n的比值是( )
| A、1:3 | B、3:1 |
| C、1:2 | D、1:1 |
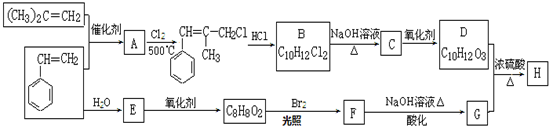
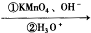 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH