题目内容
2.对 N2+3H2?2NH3 反应,仅改变下列一个条件,就能提高活化分子的浓度从而加快正反应速率的是 ( )| A. | 加热 | B. | 增大体积 | C. | 加负催化剂 | D. | 补充 He |
分析 增大浓度、增大压强、升高温度、使用催化剂等可加快反应速率,以此来解答.
解答 解:A.升高温度,活化分子的百分数增大,使正、逆化学反应速率加快,故A正确;
B.扩大容器的体积,相当于压强减小,则反应速率减小,故B错误;
C.加入负催化剂,反应速率减小,故C错误;
D.补充 He,如体积不变,参加反应气体的浓度不变,则反应速率不变,故D错误.
故选A.
点评 本题考查影响化学反应速率的因素,明确温度、浓度、压强、催化剂对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.2016年诺贝尔化学奖授予借助某些金属离子制造出复杂新分子,从而合成分子机器的三位科学家,合成新分子过程模拟如下:

下列有关信息错误的是( )

下列有关信息错误的是( )
| A. | 图中新月形分子和环状分子“组合”在一起,铜离子起关键作用 | |
| B. | 利用此方式可以合成新分子,同时也可能创造一种全新“机械键” | |
| C. | 在创造新分子技术中,铜离子是唯一可以借助的金属离子 | |
| D. | 此技术可以“互锁”合成 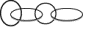 分子,甚至成更复杂的分子 分子,甚至成更复杂的分子 |
10.将C(H+)相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断:
(1)反应所需时间:乙<甲
(2)开始时反应速率:甲>乙
(3)参加反应的锌的质量:甲=乙
(4)整个反应阶段的平均速率:乙>甲
(5)盛盐酸的容器中有锌剩余
(6)盛醋酸的容器中有锌剩余.
以上判断正确的是( )
(1)反应所需时间:乙<甲
(2)开始时反应速率:甲>乙
(3)参加反应的锌的质量:甲=乙
(4)整个反应阶段的平均速率:乙>甲
(5)盛盐酸的容器中有锌剩余
(6)盛醋酸的容器中有锌剩余.
以上判断正确的是( )
| A. | (1)(2)(3)(5) | B. | (1)(3)(5) | C. | (2)(3)(6) | D. | (1)(3)(4)(5) |
7.下列条件下,对应离子一定能大量共存的是( )
| A. | 在0.1mol/LNaHCO3溶液中:Al3+、NH4+、SO42-、NO3- | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:K+,Cl-,Fe2+,NO3- | |
| C. | 使甲基橙变红的溶液中:NH4+,Cl-,SO2-,Mg2+ | |
| D. | 25℃时,水电离出的c(H+)=1×10-13mol/L:K+,Ba2+,NO3-,S2- |
14.下列关于有机化合物的说法正确的是( )
| A. | 苯的三氯代物一共有 5 种 | |
| B. | 乙烯和乙酸均能发生加成反应 | |
| C. | 乙烷通入氯水中能发生取代反应 | |
| D. | 淀粉和纤维素都属于天然高分子化合物 |
11.下列离子方程式中,书写不正确的是( )
| A. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| B. | 纯碱溶液与石灰水反应:Ca2++CO32-=CaCO3↓ | |
| C. | 铜粉与硝酸银溶液反应:Ag++Cu═Ag+Cu2+ | |
| D. | 盐酸滴在石灰石上:CaCO3+2H+=Ca2++CO2↑+H2O |
12.下列说法不正确的是( )
| A. | 糖类、油脂、蛋白质都能发生水解反应 | |
| B. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物 | |
| D. | 油脂有油和脂肪之分,但都属于酯 |
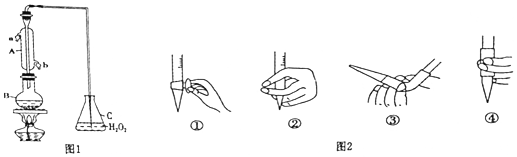
 Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.该小组同学用Na2SO3与浓硫酸制备SO2,并把SO2通入NaNO3溶液中,他们为了检验产生的气体是NO还是
Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.该小组同学用Na2SO3与浓硫酸制备SO2,并把SO2通入NaNO3溶液中,他们为了检验产生的气体是NO还是