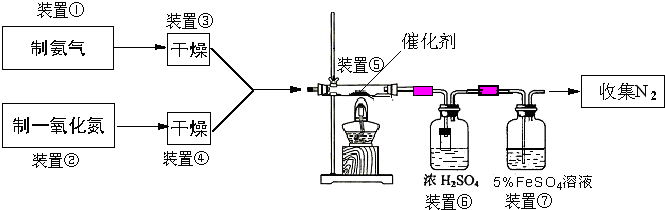
题目内容
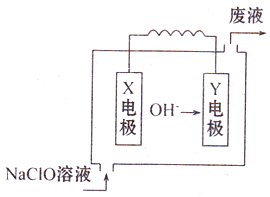 如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.
如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.(1)Y电极材料为
(2)X电极发生的电极反应式为
(3)若该电池开始时加入1L 0.2mol/L的NaOH溶液,然后从下口充入1L 0.1mol/L的NaClO溶液(忽略整个过程的体积变化),当NaClO完全放电时溶液的PH=
考点:原电池和电解池的工作原理
专题:
分析:由Mg-NaClO燃料电池结构示意图可知,氢氧根离子向Y极移动,则Y为负极,X为正极,负极上Mg失电子,正极上NaClO得电子,燃料电池中失电子的一极为负极,根据电池中的总反应计算消耗的氢氧根离子,再计算pH.
解答:
解:(1)由Mg-NaClO燃料电池结构示意图可知,氢氧根离子向Y极移动,则Y为负极,X为正极,负极上Mg失电子,故答案为:Mg;
(2)X为正极,正极上NaClO得电子,则正极上的电极方程式为:ClO-+2e-+H2O=Cl-+2OH-;
故答案为:ClO-+2e-+H2O=Cl-+2OH-;
(3)Mg-NaClO燃料电池的总反应为ClO-+Mg+H2O=Cl-+Mg(OH)2↓,反应不消耗氢氧化钠,也不生成氢氧根离子,则1L 0.2mol/L的NaOH溶液,再充入1L 0.1mol/L的NaClO溶液,溶液体积变为2L,则NaOH溶液的浓度变为 0.1mol/L,则c(H+)=
=10-13mol/L,所以pH=13;
故答案为:13.
(2)X为正极,正极上NaClO得电子,则正极上的电极方程式为:ClO-+2e-+H2O=Cl-+2OH-;
故答案为:ClO-+2e-+H2O=Cl-+2OH-;
(3)Mg-NaClO燃料电池的总反应为ClO-+Mg+H2O=Cl-+Mg(OH)2↓,反应不消耗氢氧化钠,也不生成氢氧根离子,则1L 0.2mol/L的NaOH溶液,再充入1L 0.1mol/L的NaClO溶液,溶液体积变为2L,则NaOH溶液的浓度变为 0.1mol/L,则c(H+)=
| Kw |
| c(OH-) |
故答案为:13.
点评:本题综合考查原电池知识、溶液中pH的计算,为高频考点,侧重于学生的分析能力的考查,注意把握电极方程式的书写,为解答该类题目的关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
C(石墨)=C(金刚石),△H=+1.895kJ/mol,相同条件下,下列说法正确的是( )
| A、石墨比金刚石稳定 |
| B、金刚石比石墨稳定 |
| C、相同物质的量的石墨比金刚石的总能量高 |
| D、两者互为同位素 |
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4、CuSO4五瓶溶液加以区别的一种试剂是(必要时可以加热)( )
| A、BaCl2 |
| B、NaOH |
| C、AgNO3 |
| D、Ba(OH)2 |
用NA表示阿伏加德罗常数,n表示物质的量,N表示微粒数.下列各项正确的是( )
| A、常温常压下,1mol氦气含有的原子数为NA |
| B、0.10 mol?L-1 NaCl溶液中含有Cl-离子数是0.1 NA |
| C、NA个O2分子的质量是16 g |
| D、标准状况下,22.4 L水中含有的水分子数是NA |