题目内容
选择性催化还原(SCR)是在有催化剂的条件下将NOx 转变为N2和H2O,这是目前国外硝酸厂进行尾气治理所普遍采用的一种方法.某校甲、乙两个化学兴趣小组拟验证NO能被氨气还原并测算其转化率.
A.甲组拟制取活性亚铬酸铜催化剂亚铬酸铜(Adkin催化剂)是极好的NO催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:CuO?Cr2O3等,统称为亚铬酸铜.该组同学取一定量硝酸铜溶液(并加少量硝酸钡作稳定剂)、重铬酸铵溶液与氨水作用得土黄色沉淀,将沉淀物[经测定为:碱式铬酸铜铵(CuNH4(OH)CrO4 )]过滤、洗涤,80℃烘干12h,最后焙烧.
(1)过滤用到的玻璃仪器有: (选填序号,下同);焙烧用到的仪器有: .
A.蒸发皿 B.石棉网 C.泥三角 D.烧杯 E.坩埚钳
F.酒精灯 G.玻璃棒 H.漏斗 I.坩埚(部分仪器已略去)
(2)CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,该反应的化学方程 .
B.乙组拟用甲组制得催化剂按下列流程进行实验.
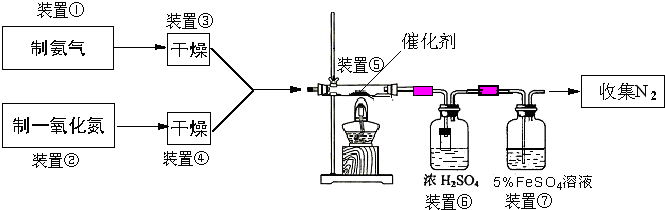
试回答下列问题:
(3)如下图,若制取氨气在A装置,则发生反应的化学方程式为: ;若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是: .

(4)用图C装置制取NO时,用可抽动的铜丝其优点是: ;
(5)装置⑦的作用可能是 .
(6)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mL N2,则NO的转化率为: .
A.甲组拟制取活性亚铬酸铜催化剂亚铬酸铜(Adkin催化剂)是极好的NO催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:CuO?Cr2O3等,统称为亚铬酸铜.该组同学取一定量硝酸铜溶液(并加少量硝酸钡作稳定剂)、重铬酸铵溶液与氨水作用得土黄色沉淀,将沉淀物[经测定为:碱式铬酸铜铵(CuNH4(OH)CrO4 )]过滤、洗涤,80℃烘干12h,最后焙烧.
(1)过滤用到的玻璃仪器有:
A.蒸发皿 B.石棉网 C.泥三角 D.烧杯 E.坩埚钳
F.酒精灯 G.玻璃棒 H.漏斗 I.坩埚(部分仪器已略去)
(2)CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,该反应的化学方程
B.乙组拟用甲组制得催化剂按下列流程进行实验.

试回答下列问题:
(3)如下图,若制取氨气在A装置,则发生反应的化学方程式为:

(4)用图C装置制取NO时,用可抽动的铜丝其优点是:
(5)装置⑦的作用可能是
(6)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mL N2,则NO的转化率为:
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据过滤操作所需仪器进行;根据灼烧所需仪器进行;
(2)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,根据质量守恒书写化学方程式;
(3)在加热条件下,实验室常用氯化铵和氢氧化钙反应制备氨气,同时生产氯化钙和水,实验室制备少量氨气时可根据氨水的易挥发性和碱石灰的吸水性来制取;
(4)用可抽动的铜丝易于控制反应,操作方便;
(5)硫酸亚铁吸收NO,生成配合物;
(6)根据反应6NO+4NH3═5N2+6H2O计算转化率.
(2)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,根据质量守恒书写化学方程式;
(3)在加热条件下,实验室常用氯化铵和氢氧化钙反应制备氨气,同时生产氯化钙和水,实验室制备少量氨气时可根据氨水的易挥发性和碱石灰的吸水性来制取;
(4)用可抽动的铜丝易于控制反应,操作方便;
(5)硫酸亚铁吸收NO,生成配合物;
(6)根据反应6NO+4NH3═5N2+6H2O计算转化率.
解答:
解:(1)过滤所需玻璃仪器为:烧杯、玻璃棒、漏斗;灼烧所需仪器为:坩埚、坩埚钳、泥三角、酒精灯、玻璃棒;故答案为:D、G、H;C、E、F、G、I;
(2)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,反应方程式为2Cu(OH)NH4CrO4
Cr2O3?2CuO+N2↑+5H2O,
故答案为:2Cu(OH)NH4CrO4
Cr2O3?2CuO+N2↑+5H2O;
(3)在加热条件下,实验室常用氯化铵和氢氧化钙反应制备氨气,同时生产氯化钙和水,方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,实验室制备少量氨气时可根据氨水的易挥发性和碱石灰的吸水性来制取,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;浓氨水、碱石灰;
(4)铜和稀硝酸反应生产硝酸铜和一氧化氮,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,用可抽动的铜丝易于控制反应,操作方便并能节约药品,
故答案为:反应可以随时关停、操作方便、反复使用、节约药品;
(5)一氧化氮与二价铁形成配位键,溶液中淡绿色的二价铁变成棕色的一氧化氮配合物,反应为Fe2++NO=Fe(NO)2+,故答案为:吸收未反应的NO;
(6)根据反应6NO+4NH3═5N2+6H2O计算,在一定条件下气体的体积之比等于物质的量之比,
6NO+4NH3═5N2+6H2O
6ml 5ml
V 2016ml
V=
=2419.2ml,则NO的转化率为
×100%=90%,
故答案为:90%.
(2)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,反应方程式为2Cu(OH)NH4CrO4
| ||
故答案为:2Cu(OH)NH4CrO4
| ||
(3)在加热条件下,实验室常用氯化铵和氢氧化钙反应制备氨气,同时生产氯化钙和水,方程式为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(4)铜和稀硝酸反应生产硝酸铜和一氧化氮,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,用可抽动的铜丝易于控制反应,操作方便并能节约药品,
故答案为:反应可以随时关停、操作方便、反复使用、节约药品;
(5)一氧化氮与二价铁形成配位键,溶液中淡绿色的二价铁变成棕色的一氧化氮配合物,反应为Fe2++NO=Fe(NO)2+,故答案为:吸收未反应的NO;
(6)根据反应6NO+4NH3═5N2+6H2O计算,在一定条件下气体的体积之比等于物质的量之比,
6NO+4NH3═5N2+6H2O
6ml 5ml
V 2016ml
V=
| 2016ml×6ml |
| 5ml |
| 2419.2 |
| 2688 |
故答案为:90%.
点评:本题考查氨气的制取和性质等知识,题目较为综合,具有一定难度,本题中注意少量氨气制取的方法以及NO尾气的吸收等问题,这在课本中是不多见的.

练习册系列答案
相关题目
下列关于钢铁的析氢腐蚀的说法中正确的是( )
| A、铁为正极 |
| B、碳为正极 |
| C、溶液中氢离子浓度不变 |
| D、析氢腐蚀在任何溶液中都会发生 |
将m g CaO、Na2CO3、NaHCO3、NaOH固体投入足量水中,一段时间后,对所得浊液进行分析,发现溶液中只有Na+、OH-,将所得浊液隔绝空气低温蒸干得固体为n (n>m)g,则原混合固体中Na2CO3质量为( )
| A、n-m | ||
B、
| ||
C、
| ||
| D、无法求得 |
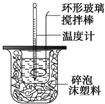 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: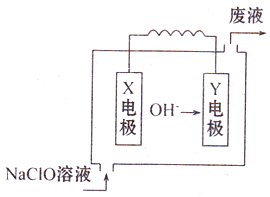 如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.
如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.