题目内容
实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,反应方程式为:CH3CH2OH
CH2=CH2↑+H2O.若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g).
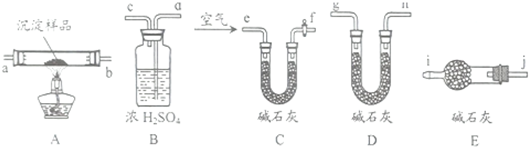
(1)试用如图所示的装置设计一个实验(必要的装置可重复使用),验证制得的气体中含有乙烯,二氧化碳,二氧化硫和水蒸气,按气流的方向,各装置的连接顺序是

(2)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是 ,B瓶的作用是 ,C瓶的作用是 .
(3)检查装置④的气密性操作是:
(4)若气体通过装置③中所盛溶液时,产生白色沉淀,它可以用来验证的气体是 .若气体通过装置③中所盛溶液时,溶液的颜色消失,则该溶液的名称是 .
(5)装置②中所加的试剂名称是 ,它可以验证的气体是 ,简述确定装置②在整套装置中的位置的理由是 .
(6)某同学做此实验时发现装置④存在的不妥之处是: .
| 浓硫酸 |
| 170℃ |
(1)试用如图所示的装置设计一个实验(必要的装置可重复使用),验证制得的气体中含有乙烯,二氧化碳,二氧化硫和水蒸气,按气流的方向,各装置的连接顺序是

(2)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是
(3)检查装置④的气密性操作是:
(4)若气体通过装置③中所盛溶液时,产生白色沉淀,它可以用来验证的气体是
(5)装置②中所加的试剂名称是
(6)某同学做此实验时发现装置④存在的不妥之处是:
考点:乙醇的消去反应
专题:实验设计题
分析:(1)(2)检验二氧化硫可用品红溶液,检验二氧化碳可以用澄清石灰水,检验水用无水硫酸铜,三者都有时,应先通过无水硫酸铜检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,二氧化碳的检验应放在排除SO2的干扰后进行,所以应先无水硫酸铜检验水蒸气的存在,通过品红溶液褪色检验SO2的存在,再通过酸性高锰酸钾溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用澄清石灰水实验检验二氧化碳;
(3)利用液差法检查装置的气密性;
(4)用澄清石灰水实验检验二氧化碳;根据乙烯能使溴的四氯化碳溶液褪色;
(5)先通过无水硫酸铜检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;
(6)实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,需要温度计测定溶液温度;
(3)利用液差法检查装置的气密性;
(4)用澄清石灰水实验检验二氧化碳;根据乙烯能使溴的四氯化碳溶液褪色;
(5)先通过无水硫酸铜检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;
(6)实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,需要温度计测定溶液温度;
解答:
解:(1)检验二氧化硫可用品红溶液,检验二氧化碳可以用澄清石灰水,检验水用无水硫酸铜,三者都有时,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,二氧化碳的检验应放在排除SO2的干扰后进行,所以应先通过品红溶液褪色检验SO2的存在,再通过酸性高锰酸钾溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用澄清石灰水实验检验二氧化碳;
故答案为:④②①③;
(2)检验二氧化硫可用品红溶液,二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,二氧化碳的检验应放在排除SO2的干扰后进行,所以应先通过品红溶液褪色检验SO2的存在,再通过酸性高锰酸钾溶液除去SO2,接着通过品红溶液不褪色确认SO2已除干净;
故答案为:检验是否有SO2;除去或吸收SO2;检验SO2是否除尽;
(3)由图中装置可知,关闭止水夹,从通过分液漏斗向烧瓶中加水至水不再流下,说明气密性良好,以此来检查装置的气密性;
故答案为:关闭止水夹,通过分液漏斗向烧瓶中加水至水不再流下,说明气密性良好;
(4)用澄清石灰水实验检验二氧化碳,若气体通过装置③中所盛溶液澄清石灰水时,产生白色沉淀;
乙烯能使溴的四氯化碳溶液褪色,若气体通过装置③中所盛溶液溴的四氯化碳溶液时,溶液的颜色消失;
故答案为:CO2;溴的四氯化碳溶液;
(5)先通过无水硫酸铜检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气,影响水蒸气的确定;
故答案为:无水硫酸铜;水蒸气;①③导出的气体带有水蒸气,影响水蒸气的确定;
(6)实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,需要温度计测定溶液温度;
故答案为:发生装置中缺少温度计;
故答案为:④②①③;
(2)检验二氧化硫可用品红溶液,二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,二氧化碳的检验应放在排除SO2的干扰后进行,所以应先通过品红溶液褪色检验SO2的存在,再通过酸性高锰酸钾溶液除去SO2,接着通过品红溶液不褪色确认SO2已除干净;
故答案为:检验是否有SO2;除去或吸收SO2;检验SO2是否除尽;
(3)由图中装置可知,关闭止水夹,从通过分液漏斗向烧瓶中加水至水不再流下,说明气密性良好,以此来检查装置的气密性;
故答案为:关闭止水夹,通过分液漏斗向烧瓶中加水至水不再流下,说明气密性良好;
(4)用澄清石灰水实验检验二氧化碳,若气体通过装置③中所盛溶液澄清石灰水时,产生白色沉淀;
乙烯能使溴的四氯化碳溶液褪色,若气体通过装置③中所盛溶液溴的四氯化碳溶液时,溶液的颜色消失;
故答案为:CO2;溴的四氯化碳溶液;
(5)先通过无水硫酸铜检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气,影响水蒸气的确定;
故答案为:无水硫酸铜;水蒸气;①③导出的气体带有水蒸气,影响水蒸气的确定;
(6)实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,需要温度计测定溶液温度;
故答案为:发生装置中缺少温度计;
点评:本题考查乙烯的化学性质、制备以及常见气体的检验,题目难度不大,注意实验原理及检验的先后顺序.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中不正确的是.( )
| A、从1L 1mol/L的NaCl溶液中取出 10mL,其浓度仍是1mol/L |
| B、制成0.5 L 10 mol/L的盐酸,而要氯化氢气体112 L(标准状况) |
| C、0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
| D、10g 98%的硫酸(密度为1.84 g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
反应3X(g)+Y(g)?Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率为( )
| A、v(X)=0.03 mol/(L?min) |
| B、v(Y)=0.02 mol/(L?min) |
| C、v(Z)=0.10 mol/(L?min) |
| D、v(w)=0.20 mol/(L?min) |
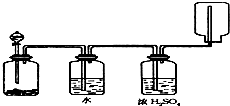 如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )
如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )| A、二氧化锰和双氧水反应生成氧气 |
| B、浓氨水和生石灰混合生成氨气 |
| C、Na2SO3和浓H2SO4混合生成SO2 |
| D、锌粒与稀盐酸混合生成H2 |




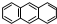 分子式C14H10)反应生成蒽醌(
分子式C14H10)反应生成蒽醌(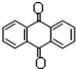 分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.
分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.