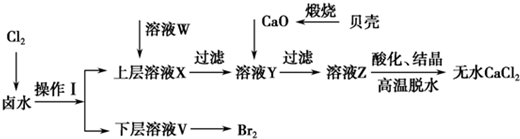
题目内容
根据下列框图,下列说法正确的是( )
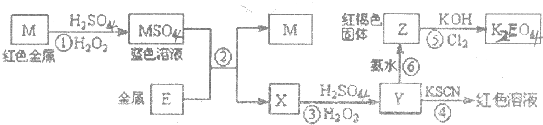

| A、M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B、反应①、②、③、④、⑤都属于氧化还原反应,且在反应①和③中硫酸都是既表现了酸性、又表现了氧化性 |
| C、用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH- |
| D、反应④、⑥的离子方程式分别可表示为E3++3SCN-=E(SCN)3,3NH3﹒H2O+E3+═E(OH)3↓+3NH4+ |
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:流程分析可知,M为铜,在酸性溶液中被过氧化氢氧化为铜盐溶液CuSO4,依据Y加入KSCN溶液血红色说明是Fe3+离子,和氨水反应生成红褐色沉淀氢氧化铁;说明X为亚铁离子形成的硫酸亚铁溶液,推断E为Fe,则X为FeSO4,Y为Fe2(FeSO4)3,Z为Fe(OH)3,
A.Fe2+的氧化性比Cu2+的氧化性弱,但Fe3+的氧化性比Cu2+强;
B.反应①、②、③、⑤都属于氧化还原反应,④不属于氧化还原反应,①和③中硫酸都只表现了酸性;
C.原电池负极发生氧化反应,在K2EO4、Zn制成的高能电池中锌失去电子;
D.Fe3+可与SCN-发生络合反应,Fe3+与碱反应生成沉淀.
A.Fe2+的氧化性比Cu2+的氧化性弱,但Fe3+的氧化性比Cu2+强;
B.反应①、②、③、⑤都属于氧化还原反应,④不属于氧化还原反应,①和③中硫酸都只表现了酸性;
C.原电池负极发生氧化反应,在K2EO4、Zn制成的高能电池中锌失去电子;
D.Fe3+可与SCN-发生络合反应,Fe3+与碱反应生成沉淀.
解答:
解:流程分析可知,M为铜,在酸性溶液中被过氧化氢氧化为铜盐溶液CuSO4,依据Y加入KSCN溶液血红色说明是Fe3+离子,和氨水反应生成红褐色沉淀氢氧化铁,说明X为亚铁离子形成的硫酸亚铁溶液,推断E为Fe,则X为FeSO4,Y为Fe2(FeSO4)3,Z为Fe(OH)3,
A.M为铜离子,E为铁,铁的金属性强于铜,Fe2+的氧化性比Cu2+的氧化性弱,但Fe3+的氧化性比Cu2+强,如2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.①②⑤都有单质参加反应,③有过氧化氢参加反应,则一定为氧化还原反应,④发生Fe3++3SCN-=Fe(SCN)3,不属于氧化还原反应,①和③中硫酸都只表现了酸性,表现氧化性的为过氧化氢,故B错误;
C.原电池负极发生氧化反应,用K2EO4、Zn可制成的高能电池,应是锌失电子被氧化,故C错误;
D.Fe3+可与SCN-发生络合反应,Fe3+与碱反应生成沉淀,反应的离子方程式分别为Fe3++3SCN-═Fe(SCN)3、3NH3?H2O+Fe3+═Fe(OH)3↓+3NH4+,故D正确;
故选D.
A.M为铜离子,E为铁,铁的金属性强于铜,Fe2+的氧化性比Cu2+的氧化性弱,但Fe3+的氧化性比Cu2+强,如2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.①②⑤都有单质参加反应,③有过氧化氢参加反应,则一定为氧化还原反应,④发生Fe3++3SCN-=Fe(SCN)3,不属于氧化还原反应,①和③中硫酸都只表现了酸性,表现氧化性的为过氧化氢,故B错误;
C.原电池负极发生氧化反应,用K2EO4、Zn可制成的高能电池,应是锌失电子被氧化,故C错误;
D.Fe3+可与SCN-发生络合反应,Fe3+与碱反应生成沉淀,反应的离子方程式分别为Fe3++3SCN-═Fe(SCN)3、3NH3?H2O+Fe3+═Fe(OH)3↓+3NH4+,故D正确;
故选D.
点评:本题考查无机物的推断,侧重于学生的分析能力的考查,较为综合,涉及氧化性的强弱以及电化学知识,难度中等,注意根据物质的颜色作为本题的突破口.

练习册系列答案
相关题目
关于Na2O2与CO2、H2O反应的叙述正确的是( )
| A、Na2O2与CO2反应中,Na2O2只作还原剂,CO2作氧化剂 |
| B、Na2O2与H2O反应中,Na2O2既作氧化剂又做还原剂 |
| C、Na2O2与CO2反应中,1mol Na2O2转移2mol电子 |
| D、Na2O2与水反应中,1mol Na2O2转移1mol电子 |
下列物质中属于电解质的是( )
| A、石墨 |
| B、CO2 |
| C、BaSO4 |
| D、Fe |
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )

| A、O~A段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O |
| B、A~B段反应的离子方程式是2OH-+CO2═CO32-+H2O |
| C、A~B段与C~D段所发生的反应相同 |
| D、D~E段沉淀的减少是由于碳酸钡固体的溶解所致 |
用下列实验装置完成对应的实验,能达到实验目的是( )
A、 用酒精从碘水中萃取碘 |
B、 收集H2或CO2 |
C、 从食盐水中提取NaCl |
D、 石油的分馏 |
要检验溴乙烷中的溴元素,下列实验方法正确的是( )
| A、加入新制的氯水振荡,再加入少量CCl4振荡,观察下层是否变为橙红色 |
| B、加入硝酸银溶液,再加入稀硝酸使溶液呈酸性,观察有无浅黄色沉淀生成 |
| C、加入NaOH溶液共热,冷却后加入硝酸银溶液,观察有无浅黄色沉淀生成 |
| D、加入NaOH溶液共热,冷却后加入稀硝酸使溶液呈酸性,再滴入硝酸银溶液,观察有无浅黄色沉淀生成 |
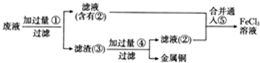 电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.
电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.