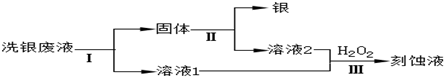
题目内容
19.V mLFe2(SO4)3溶液中含a g SO42-,取出溶液$\frac{V}{2}$mL,用水稀释成2V mL,则稀释后溶液Fe3+的物质的量浓度是( )| A. | $\frac{125a}{72V}$ mol•L-1 | B. | $\frac{125a}{36V}$ mol•L-1 | C. | $\frac{250a}{36V}$ mol•L-1 | D. | $\frac{250a}{48V}$ mol•L-1 |
分析 根据n=$\frac{m}{M}$计算出agSO42-的物质的量,再根据硫酸铁的化学式组成计算出铁离子的物质的量,再计算出$\frac{1}{2}$VmL溶液中铁离子的物质的量,最后根据c=$\frac{n}{V}$计算出稀释后溶液中铁离子的物质的量浓度.
解答 解:ag SO42-离子的物质的量为:n(SO42-)=$\frac{ag}{96g/mol}$=$\frac{a}{96}$mol,
V mL Fe2(SO4)3溶液中含有Fe3+离子的物质的量为:n(Fe3+)=$\frac{2}{3}$×n(SO42-)=$\frac{a}{96}$mol×$\frac{2}{3}$=$\frac{a}{144}$mol,
$\frac{1}{2}$V mL溶液中含有Fe3+的物质的量为:n(Fe3+)=$\frac{a}{144}$mol×$\frac{1}{2}$=$\frac{a}{288}$mol,
稀释后溶液体积为2VmL,则溶液中Fe3+的浓度为:c(Fe3+)=$\frac{\frac{a}{288}mol}{2V×1{0}^{-3}L}$=$\frac{125a}{72V}$mol/L,
故选A.
点评 本题考查了物质的量浓度的相关计算,题目难度中等,要求学生熟练掌握物质的量浓度的计算公式,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.已知1个N2O3分子的质量为a g,1个N2O5分子的质量为b g.若以16O原子质量的$\frac{1}{16}$作为相对原子质量的标准,则NO2的相对分子质量为( )
| A. | $\frac{16(b+a)}{b-a}$ | B. | $\frac{16(b-a)}{b+a}$ | C. | $\frac{8(b+a)}{b-a}$ | D. | $\frac{8(b-a)}{b+a}$ |
14.以下说法正确的是( )
| A. | 石英玻璃是以纯碱、石灰石和二氧化硅为原料制成的 | |
| B. | 氮的固定是指将空气中游离的氮转变为氮的化合物的方法 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 纳米材料是指一种称为“纳米”的新物质制成的材料 |
4.丁烷催化裂化时,碳链按两种方法断裂,生成两种烷烃和两种烯烃.如果丁烷的分解率为90%,且裂化生成的两种烯烃的物质的量相等,那么裂化所得气体中密度最小的气体在混合气体中占的体积百分含量约为( )
| A. | 24% | B. | 30% | C. | 40% | D. | 19% |
8.如图中实验现象预测正确的是( )


| A. | 实验Ⅰ:导管口气体可被点燃,产生淡蓝色火焰 | |
| B. | 实验Ⅱ:振荡后静置,溶液分层,且两层均接近无色 | |
| C. | 实验Ⅲ:试管中有气泡冒出,溶液颜色无明显变化 | |
| D. | 实验Ⅳ:试管内气体颜色逐渐变浅,试管壁出现油状液滴 |
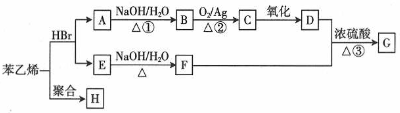
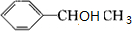 ;H的结构简式
;H的结构简式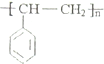 .
.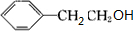 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2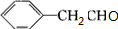 +2H2O ③
+2H2O ③ +
+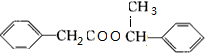 +H2O
+H2O .(任写一种)
.(任写一种)