题目内容
(8分)氢氧化钾是重要的工业产品。请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是 。
(2)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因: 。
③除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
(1)2Al+2OH-+2H2O===2AlO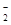 +3H2↑(2分);(2) ①4OH--4e-===2H2O+O2↑(2分);
+3H2↑(2分);(2) ①4OH--4e-===2H2O+O2↑(2分);
②H+放电,促进水的电离,OH-浓度增大(2分)③B(2分)
解析试题分析:(1)铝与氢氧化钾溶液反应的离子方程式是2Al+2OH-+2H2O===2AlO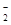 +3H2↑;(2)①在阳极由于放电能力OH->含氧酸根离子,所以该电解槽的阳极反应式是4OH--4e-===2H2O+O2↑;②在阴极是H+放电,由于随着电解反应的进行,H+放电,破坏了水的电离平衡,促进水的电离,最终OH-浓度增大,所以阴极附近溶液pH会增大;③由于在阳极区K+的浓度大,而且该区域的H+放电,溶液显碱性,所以除去杂质后的氢氧化钾溶液从液体出口是B口。
+3H2↑;(2)①在阳极由于放电能力OH->含氧酸根离子,所以该电解槽的阳极反应式是4OH--4e-===2H2O+O2↑;②在阴极是H+放电,由于随着电解反应的进行,H+放电,破坏了水的电离平衡,促进水的电离,最终OH-浓度增大,所以阴极附近溶液pH会增大;③由于在阳极区K+的浓度大,而且该区域的H+放电,溶液显碱性,所以除去杂质后的氢氧化钾溶液从液体出口是B口。
考点:考查离子方程式的书写、电解原理的应用、反应条件的控制及物质的分离的知识。

有一合金由X、Y、Z、W四种金属组成
①若将合金放入盐酸中只有Z、Y能溶解
②若将合金置于潮湿空气中,表面只出现Z的化合物
③若将该合金作阳极,用X盐溶液作电解质溶液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是( )
| A.Y>Z>W>X | B.Z>Y>W>X |
| C.W>Z>Y>X | D.X>Y>Z>W |
关于下图所示的原电池,下列说法正确的是 
| A.电子从锌电极通过电流表流向铜电极 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.取出盐桥后,电流计的指针仍发生偏转 |
| D.铜电极上发生的电极反应是2H+ + 2e- = H2↑ |
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
| A.正极附近的SO42―离子浓度逐渐增大 |
| B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 |
| D.铜片上有H2逸出 |
下列有关电池叙述不正确的是( )
| A.锌锰干电池是一种常用的二次电池 |
| B.氢氧燃料电池比火力发电的能量转变率要高 |
| C.锌锰干电池工作一段时间后锌外壳逐渐变薄 |
| D.碱性燃料电池正极反应是O2 + 2H2O + 4e- =4OH- |
(10分)
(1)铅蓄电池中,作负极材料的金属在元素周期表中的位置是________________,写出其正极的电极反应式______________________________________________________;
(2)汽车尾气分析仪对 CO 的分析 以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2- 可以在固体介质中自由移动。
下列说法错误的是___________________。
| A.负极的电极反应式为:CO+O2-―2e=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
某化学小组用下图装置电解CuCl2溶液制少量漂白液: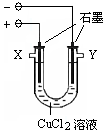

(1)其阳极的反应式是: ;导气管W端应与出气口 连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2( OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有 、或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,

进行实验。实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是 ,无水硫酸铜的作用是 ;
②d中反应的离子方程式是 ;
③装置b中发生反应的化学方程式是 。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为 。
⑤阴极上产生白色物质的物质的量是 ;若装置b冷却时不继续通H2,则计算所得Cu+的产率会 (偏大、偏小、不变)。

