题目内容
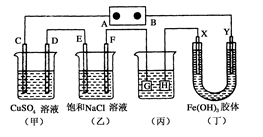
(6分)某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。当乙池中C极质量减轻10.8 g时,回答下列问题。
(1)写出A极的电极方程式: 。
(2)甲池中B电极理论上消耗O2的体积(标准状况下)为多少毫升?
(3)若丙池中溶液的体积为1000 mL,此时丙池中溶液的pH为多少?
解:(1)CH3OH-6e-+8OH-=CO32-+6H2O(2分)
(2)甲池中B电极理论上消耗O2的体积(标准状况下)为56ml。
(3)丙池中溶液的pH为1
串联装置,所以电子转移数目相等。
C极上的电极反应为:Ag - e- = Ag+
108 g 1 mol
10.8 g n(e-)
n(e-)=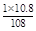 =0.1 mol (1分)
=0.1 mol (1分)
B电极上的电极反应为:O2 + 2H2O + 4e-=4OH-
1 4
n(O2) 0.1 mol
n(O2)=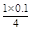 =0.025 mol
=0.025 mol
V(O2)=0.025 mol×22.4 L/mol=0.56 L=560 mL(1分)
(3)2Cu2++2H2O=2Cu+O2+4H+
4H+———— 4e-
4 mol 4 mol
n(H+) 0.1 mol
n(H+)=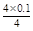 =0.1 mol(1分)
=0.1 mol(1分)
因1 L含n(H+)为0.1 mol,c(H+)=0.1 mol/L
则:pH=-lg c(H+)=-lg10-1=1(1分)
解析试题分析:(1)甲池能自发进行氧化还原反应为原电池,燃料电池中,燃料失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O。
(2)C极上的电极反应为:Ag-e-═Ag+,B电极上的电极反应为:O2+2H2O+4e-═4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.025mol,体积为0.025mol×22.4L/mol=0.056L=56mL。
(3)当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时丙池中E电极反应为2H2O-4e-═O2↑+4H+,所以生成的氢离子的物质的量0.1mol,则氢离子的浓度为0.1mol/L,所以PH=1。
考点:本题考查原电池和电解池原理。

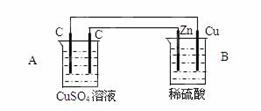
将锌片和铜片用导线连接后平行放入稀硫酸中,发生原电池反应,下列叙述错误的是
| A.溶液的pH增大 |
| B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42— 浓度增大 |
| D.溶液的密度增大 |
(14分)如下图装置所示,是用氢氧燃料电池B进行的某电解实验: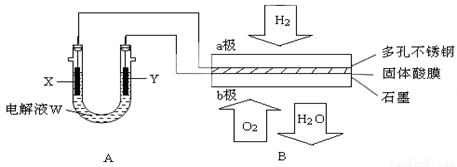
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是________。
| A.Li2NH中N的化合价是-1价 | B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+ 和H+的离子半径相等 | D.此法储氢和钢瓶储氢的原理相同 |
①若用固体Ca(HSO4)2为电解质传递H+,则电子由________极流出,H+向________极移动。(填“a”或“b”)
②b极上的电极反应式为:________________________________
③外电路中,每转移0.1 mol电子,在a极消耗________上的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCI溶液,则B工作时:
①电解池中X极上的电极反应式是 ________________________________。
在X极这边观察到的现象是 _____________________________________。
②检验Y电极上反应产物的方法是 _________________________________。
③若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是_____________________。