题目内容
20.将2mol/L HCN溶液和1mol/L NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )| A. | c(HCN)>c(CN-) | B. | c(Na+)<c(CN-) | ||
| C. | c(HCN)-c(CN-)=c(OH-) | D. | c(HCN)+c(CN-)=2 mol/L |
分析 2mol/L HCN溶液和1mol/L NaOH溶液等体积混合后,溶液中的溶质为等物质的量浓度的HCN和NaCN,溶液显碱性,说明HCN的电离程度小于NaCN水解程度,溶液中存在电荷守恒和物料守恒,结合物料守恒和电荷守恒解答.
解答 解:A.2mol/L HCN溶液和1mol/L NaOH溶液等体积混合后,溶液中的溶质为等物质的量浓度的HCN和NaCN,溶液显碱性,说明HCN的电离程度小于NaCN水解程度,则溶液中存在c(HCN)>c(CN-),故A正确;
B.溶液呈碱性,则c(H+)<c(OH-),结合电荷守恒得c(Na+)>c(CN-),故B错误;
C.由物料守恒可知c(HCN)+c(CN-)=2c(Na+),又据电荷守恒可知c(H+)+c(Na+)=c(CN-)+c(OH-),二者联式可得2c(H+)+c(HCN)+c(CN-)=2c(CN-)+2c(OH-),则2c(H+)+c(HCN)=c(CN-)+2c(OH-),c(HCN)-c(CN-)=2c(OH-)-2c(H+),故C错误;
D.二者等体积混合后溶液体积增大一倍,则浓度降为原来的一半,结合物料守恒得c(HCN)+c(CN-)=1 mol/L,故D错误;
故选A.
点评 本题考查了混合溶液中离子浓度大小的判断,为高考常见题型,侧重于学生的分析能力的考查,注意电荷守恒和物料守恒的运用,易错选项是D,注意二者混合溶液体积增大导致浓度发生变化,题目难度不大.

练习册系列答案
相关题目
8.以下实验能获得成功的是( )
| A. | 用酸性KMn04溶液鉴别乙烯和乙炔 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 苯和硝基苯采用分液的方法分离 | |
| D. | 分离沸点相差30℃以上的混溶液体,采用蒸馏的方法 |
8.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原子的质子数是其M层电子数的三倍,下列说法不正确的是( )
| X | Y | |||
| Z | W | Q |
| A. | X与Y可形成的化合物在5种以上 | |
| B. | 工业上常常通过电解Z的熔融氧化物的方法来获得Z的单质 | |
| C. | 这五种元素形成的简单离子的半径由大到小为:W>Q>X>Y>Z | |
| D. | W、Q两种元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
15.下列说法正确的是( )
| A. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) | |
| C. | 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH4+)=0.1mol/L | |
| D. | pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
5.用阳极a和阴极b电解c的水溶液一段时间,然后加入d,能使溶液恢复到电解前状态,a、b、c、d正确组合是( )
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
9.二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒.实验室通过如下过程制备二氧化氯.
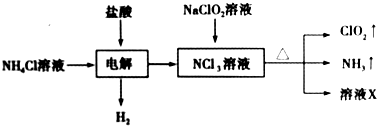
下列说法正确的是( )

下列说法正确的是( )
| A. | 电解时发生反应的离子方程式为NH4++3Cl-$\frac{\underline{\;电解\;}}{\;}$2H2↑+NCl3 | |
| B. | 溶液X中大量存在的阴离子有Cl-、OH- | |
| C. | 可用饱和食盐水除去ClO2中的NH3 | |
| D. | 可用明矾除去饮用水中残留的NaClO2 |
10.应用元素周期表和元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质.下列说法中正确的是( )
| A. | 第六周期第ⅢA族的元素Tl,其氢氧化物的碱性比Al(OH)3弱 | |
| B. | 卤族元素At的单质为有色固体,AgAt可能不溶于水也不溶于稀硝酸 | |
| C. | Li与水反应比钠与水反应剧烈 | |
| D. | H2Se是无色,有毒,比H2S稳定的气体 |