题目内容
11.镁与NO2的反应产物较复杂.某校课外活动小组欲探究镁与NO2的反应产物,提出了如下三种猜测:甲:产物为MgO;
乙:产物为Mg3N2;
丙:产物为MgO、Mg3N2的混合物.
(1)实验前,该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式4Mg+2NO2 $\frac{\underline{\;点燃\;}}{\;}$4MgO+N2.经查阅资料得知:2NO2+2NaOH═NaNO3+NaNO2+H2O.针对甲乙丙三种猜想,该小组设计如图所示的实验装置.(用于连接玻璃管的乳胶管均内衬锡纸)

(2)实验过程
①实验开始时正确的操作步骤顺序是badc(填写字母代码).
a.通入NO2 b.打开弹簧夹
c.点燃酒精灯 d.当硬质玻璃管内充满红棕色气体后,关闭弹簧夹
②装置A中的试剂是NaOH溶液.
③干燥管和装置B的作用分别是吸收NO2避免污染环境,收集N2.
(3)实验结果分析和讨论
设计实验方案,进行实验.请在下表横线上写出实验步骤以及预期现象和结论.
限选实验试剂:1mol/L硫酸、0.1mol/L盐酸、蒸馏水、红色石蕊试纸、蓝色石蕊试纸
| 实验步骤 | 预期现象 |
| 步骤1:实验完成后,将硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为26.0g | |
| 步骤2:将剩余固体加入蒸馏水中 | 有白色沉淀和有刺激性气味的气体生成 |
| 步骤3:用湿润的红色石蕊试纸检验步骤2中生成的气体 | 该气体能使湿润的红色石蕊试纸变蓝 此空删去 |
| 结论:经分析可初步确定猜想丙(填“甲、乙或丙”)是正确的,据此写出Mg与NO2反应的化学方程式7Mg+2NO2$\frac{\underline{\;\;△\;\;}}{\;}$4MgO+Mg3N2. | |
分析 (1)镁在二氧化碳气体中燃烧生成碳和氧化镁,Mg与NO2的反应类比Mg与CO2反应的思路写出;
(2)①应先在装置中充满二氧化氮气体再进行加热,按照此操作顺序进行连接;
②依据猜想镁条在二氧化氮气体中燃烧生成氮气和氧化镁,装置中A的主要作用是吸收过量二氧化氮,依据反应2NO2+2NaOH=NaNO3+NaNO2+H2O分析应选择氢氧化钠溶液;
③使装置中充满二氧化氮气体,吸收过量的二氧化氮,防止污染空气;B装置是排水量气法收集氮气;
(3)探究镁与NO2的反应产物,提出了如下三种猜测:
甲:产物为MgO;
乙:产物为Mg3N2;
丙:产物为MgO、Mg3N2的混合物.
其中氮化镁和水反应生成氢氧化镁白色沉淀和氨气,据此设计实验.
解答 解:(1)点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体为氧化镁和碳,反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,类比Mg与CO2反应的思路,镁在二氧化氮气体中反应生成氧化镁和氮气,反应的化学方程式为:4Mg+2NO2$\frac{\underline{\;点燃\;}}{\;}$4MgO+N2,
故答案为:4Mg+2NO2$\frac{\underline{\;点燃\;}}{\;}$4MgO+N2;
(2)①应先在装置中充满二氧化氮气体再进行加热,防止空气的影响,所以实验顺序为badc,
故答案为:badc;
②依据反应2NO2+2NaOH=NaNO3+NaNO2+H2O分析,装置A主要吸收多余的二氧化氮气体,需要用氢氧化钠溶液,
故答案为:NaOH溶液;
③干燥管是在充满二氧化氮气体过程中避免污染气体排放到空气中污染空气,B装置是排水量气方法收集反应生成的氮气,
故答案为:吸收NO2避免环境污染;收集N2;
(3)实验完成后,将硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为26.0g,将剩余固体加入蒸馏水中,有白色沉淀和有刺激性气味的气体生成,用湿润的红色石蕊试纸检验步骤2中生成的气体,该气体能使湿润的红色石蕊试纸变蓝证明为氨气,结合原子守恒可初步确定猜想产物为MgO、Mg3N2的混合物,反应的化学方程式为:7Mg+2NO2$\frac{\underline{\;\;△\;\;}}{\;}$4MgO+Mg3N2,
故答案为:
| 实验步骤 | 预期现象 |
| 步骤2:将剩余固体加入蒸馏水中; | 有白色沉淀和有刺激性气味的气体生成; |
| 步骤3:湿润的红色石蕊试纸; | 该气体能使湿润的红色石蕊试纸变蓝; |
| 丙;7Mg+2NO2$\frac{\underline{\;\;△\;\;}}{\;}$4MgO+Mg3N2. | |
点评 本题考查物质性质实验的设计和实验验证方法、反应现象的分析判断,依据现象判断产物是解题关键,注意实验设计的过程准确性和完整性,题目难度中等.

| A. | N2和CO | B. | CO2和N2O | C. | O3和CO2 | D. | CO32-和NO3- |
| A. | Mg、Al、K | B. | F、O、N | C. | As、P、N | D. | O、S、Cl |
Ⅰ.某研究小组将纯净的SO2气体通入0.5mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一:
①请在下表空白处填写相关实验现象
| 实 验 步 骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的10mL 0.5mol/L BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的10mL 0.5mol/L Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体. | 白色沉淀生成 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图甲.实验2中溶液pH小于实验1的原因是(用离子方程式表示)3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+.
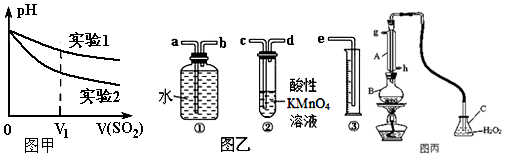
Ⅱ.我国规定空气中SO2含量不得超过0.02mg/L.某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量.
(1)若原料气从左向右流,上述装置连接的顺序是:原料气→c→d→b→a→e(用字母和箭头表示).当装置②中出现溶液紫(或紫红)色褪去现象时,立即停止通气.
(2)你认为以下试剂中,可以用来代替试管中的酸性高锰酸钾溶液的是B.
A.NaOH溶液 B.溴水C.氨水 D.BaCl2溶液
Ⅲ.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g/L.某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对含量定性测定.
(1)B中加入250.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0600mol/LNaOH标准溶液进行滴定,滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为0.192g/L.
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施盐酸易挥发,用不挥发的强酸例如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,排除盐酸挥发的影响.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |


 .
. .
. .
. 或
或 .
.
