题目内容
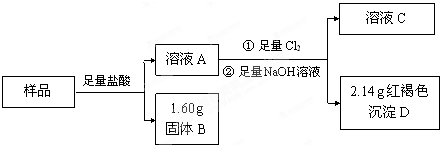
为测定氯化钾和硫酸钾混合物中氯化钾的含量,某同学设计了如下实验:称量样品,溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C.
回答下列问题:
(1)溶液A溶质的化学式 ,物质C的化学式 .
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是 .
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是 .
(4)若C的质量为23.3g,则原混合物中氯化钾的质量分数为 .
回答下列问题:
(1)溶液A溶质的化学式
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是
(4)若C的质量为23.3g,则原混合物中氯化钾的质量分数为
考点:探究物质的组成或测量物质的含量
专题:离子反应专题
分析:(1)实验的目的是:测定氯化钾和硫酸钾混合物中氯化钾的含量,氯化钾和硫酸钾都为钾盐,酸根离子不同,可利用盐将酸根离子沉淀,通过测定沉淀的盐的量测定混合物中氯化钾的含量,可用银盐沉淀氯离子或用钡盐沉淀硫酸根离子,因银盐不及钡盐经济,且将沉淀洗涤,烘干,得物质C,若用硝酸银,得到的C为混合物,所以采用钡盐,称量样品,溶解,添加适量A溶液,所以A为BaCl2,K2SO4+BaCl2=2KCl+BaSO4↓,过滤,得沉淀BaSO4和滤液B氯化钾,将沉淀洗涤,烘干,得C物质为KCl;
(2)根据天平的使用方法是左物右码,左盘的质量等于右盘的质量加游码的质量,即药品质量=砝码质量+游码质量,如果位置放反,根据左盘的质量=右盘的质量+游码的质量,列等式进行计算;
(3)根据过滤使用的仪器有滤纸、铁架台、铁圈、烧杯、漏斗、玻璃棒等分析;
(4)物质C为KCl,根据K2SO4+BaCl2=2KCl+BaSO4↓进行计算.
(2)根据天平的使用方法是左物右码,左盘的质量等于右盘的质量加游码的质量,即药品质量=砝码质量+游码质量,如果位置放反,根据左盘的质量=右盘的质量+游码的质量,列等式进行计算;
(3)根据过滤使用的仪器有滤纸、铁架台、铁圈、烧杯、漏斗、玻璃棒等分析;
(4)物质C为KCl,根据K2SO4+BaCl2=2KCl+BaSO4↓进行计算.
解答:
解:(1)实验的目的是:测定氯化钾和硫酸钾混合物中氯化钾的含量,氯化钾和硫酸钾都为钾盐,酸根离子不同,可利用盐将酸根离子沉淀,通过测定沉淀的盐的量测定混合物中氯化钾的含量,可用银盐沉淀氯离子或用钡盐沉淀硫酸根离子,因银盐不及钡盐经济,且将沉淀洗涤,烘干,得物质C,若用硝酸银,得到的C为混合物,所以采用钡盐,称量样品,溶解,添加适量A溶液,所以A为BaCl2,K2SO4+BaCl2=2KCl+BaSO4↓,过滤,得沉淀BaSO4和滤液B氯化钾,将沉淀洗涤,烘干,得C物质为KCl;
故答案为:BaCl2;BaSO4;
(2)由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量-游码质量,即实际称量物的质量=26g-0.4g=25.6g,
故答案为:25.6g;
(3)过滤使用的仪器有滤纸、铁架台、铁圈、烧杯、漏斗、玻璃棒,题目中缺少玻璃棒,
故答案为:玻璃棒;
(4)设25.6g氯化钾和硫酸钾混合物中硫酸钾的质量为x,氯化钾的质量为25.6-x,生成的氯化钾的质量为y,
则K2SO4+BaCl2=2KCl+BaSO4↓
174 149
x y
=
,解得:y=
,则
+25.6-x=23.3,解得x≈17.4,
则原混合物中氯化钾的质量分数为
×100%≈32%,
故答案为:32%.
故答案为:BaCl2;BaSO4;
(2)由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量-游码质量,即实际称量物的质量=26g-0.4g=25.6g,
故答案为:25.6g;
(3)过滤使用的仪器有滤纸、铁架台、铁圈、烧杯、漏斗、玻璃棒,题目中缺少玻璃棒,
故答案为:玻璃棒;
(4)设25.6g氯化钾和硫酸钾混合物中硫酸钾的质量为x,氯化钾的质量为25.6-x,生成的氯化钾的质量为y,
则K2SO4+BaCl2=2KCl+BaSO4↓
174 149
x y
| 174 |
| 149 |
| x |
| y |
| 149x |
| 174 |
| 149x |
| 174 |
则原混合物中氯化钾的质量分数为
| 25.6-17.4 |
| 25.6 |
故答案为:32%.
点评:本题考查了氯化钾和硫酸钾的性质、化学实验方案的设计与评价,题目难度中等,注意掌握氯化钾和硫酸钾的性质,明确实验方案的设计与评价方法,试题有利于提高学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
保护环境是公民的责任和义务.下列说法正确的是( )
| A、使用明矾净水的好处是杀菌、消毒,吸附水中的悬浮物 |
| B、减少使用氟氯代烃的目的是为了减少酸雨 |
| C、大量开采地下水,矿产资源,以满足社会经济发展的需求 |
| D、氢燃料汽车的使用,可以有效减少城市空气污染 |
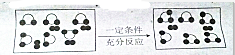 假设一定条件下某密闭容器中存在如图所示反应(空心球代表X原子,实心球代表Y原子),下列有关该反应的说法中不正确的是( )
假设一定条件下某密闭容器中存在如图所示反应(空心球代表X原子,实心球代表Y原子),下列有关该反应的说法中不正确的是( )| A、该反应一定是可逆反应 |
| B、该反应一定是氧化还原反应 |
| C、该反应一定是放热反应 |
| D、该反应的方程式可表示为2XY2+Y2?2XY3 |
在下列各组溶液中,离子能够大量共存的是( )
| A、酸性溶液中:CO32- SO42- Fe2+ Na+ |
| B、强碱性溶液中:Cl- NO3- Ba2+ K+ |
| C、无色澄清透明的溶液中:MnO4- Al3+ SO42- K+ |
| D、PH=7的溶液中:Fe3+ Cl- Al3+ NO3- |
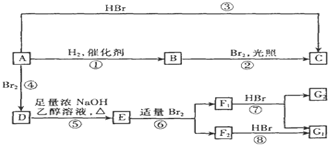 (D是
(D是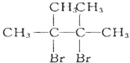 )
)