题目内容
写出10mL0.1mol/L的NaOH与20mL0.1mol/LNH4Cl溶液混合后,溶液显碱性.判断溶液汇总存在的微粒种类,并比较微粒浓度大小,写出电荷守恒和物料守恒等式.
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:10mL0.1mol/L的NaOH溶液中氢氧化钠的物质的量为:0.1mol/L×0.01L=0.001mol,20mL0.1mol/LNH4Cl溶液中氯化铵的物质的量为:0.1mol/L×0.02L=0.002mol,根据离子方程式NH4++OH-═NH3?H2O可知,反应后溶质为:0.001molNH3?H2O、0.001molNH4Cl和0.001molNaCl,据此判断混合液中存在的微粒种类、微粒浓度大小,并写出电荷守恒和物料守恒等式.
解答:
解:10mL0.1mol/L的NaOH溶液中氢氧化钠的物质的量为:0.1mol/L×0.01L=0.001mol,
20mL0.1mol/LNH4Cl溶液中氯化铵的物质的量为:0.1mol/L×0.02L=0.002mol,
根据离子方程式NH4++OH-═NH3?H2O可知,反应后溶质为:0.001molNH3?H2O、0.001molNH4Cl和0.001molNaCl,
溶液中存在的微粒有:H2O、NH3?H2O、Cl-、NH4+、OH-、H+、Na+,总共有7种微粒;
由于混合液为碱性,则一水合氨的电离程度大于铵根离子的水解程度,钠离子、氯离子不水解,则:c(Cl-)>c(NH4+)>c(Na+)>c(NH3?H2O)、c(OH-)>c(H+),则混合液中离子浓度大小为:c(Cl-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+);
溶液中电荷守恒为:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(Cl-);
混合液中物料守恒为:c(Cl-)=c(NH4+)+c(NH3?H2O)=2c(Na+),
答:混合液中存在的微粒为:H2O、NH3?H2O、Cl-、NH4+、OH-、H+、Na+;混合液中离子浓度大小为:c(Cl-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+);溶液中电荷守恒为:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(Cl-);混合液中物料守恒为:c(Cl-)=c(NH4+)+c(NH3?H2O)=2c(Na+).
20mL0.1mol/LNH4Cl溶液中氯化铵的物质的量为:0.1mol/L×0.02L=0.002mol,
根据离子方程式NH4++OH-═NH3?H2O可知,反应后溶质为:0.001molNH3?H2O、0.001molNH4Cl和0.001molNaCl,
溶液中存在的微粒有:H2O、NH3?H2O、Cl-、NH4+、OH-、H+、Na+,总共有7种微粒;
由于混合液为碱性,则一水合氨的电离程度大于铵根离子的水解程度,钠离子、氯离子不水解,则:c(Cl-)>c(NH4+)>c(Na+)>c(NH3?H2O)、c(OH-)>c(H+),则混合液中离子浓度大小为:c(Cl-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+);
溶液中电荷守恒为:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(Cl-);
混合液中物料守恒为:c(Cl-)=c(NH4+)+c(NH3?H2O)=2c(Na+),
答:混合液中存在的微粒为:H2O、NH3?H2O、Cl-、NH4+、OH-、H+、Na+;混合液中离子浓度大小为:c(Cl-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+);溶液中电荷守恒为:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(Cl-);混合液中物料守恒为:c(Cl-)=c(NH4+)+c(NH3?H2O)=2c(Na+).
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,正确判断混合液中的溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理,明确判断溶液中各离子浓度大小常用方法,试题充分培养了学生的分析、理解能力.

练习册系列答案
相关题目
化工生产中常用的CO和H2,可通过烃与水蒸气反应得到.其中甲烷可发生以下两个反应:
(1)CH4(g)+
O2(g)=2H2(g)+CO(g);△H=-36kJ/mol
(2)CH4(g)+H2O(g)=CO(g)+3H2(g);△H=+216kJ/mol
下列化学反应方程式中,反应热为零的是( )
(1)CH4(g)+
| 1 |
| 2 |
(2)CH4(g)+H2O(g)=CO(g)+3H2(g);△H=+216kJ/mol
下列化学反应方程式中,反应热为零的是( )
| A、7CH4(g)+3O2(g)+H2O(g)=7CO(g)+15H2(g) |
| B、5CH4(g)+2O2(g)+H2O(g)=5CO(g)+11H2(g) |
| C、4CH4(g)+O2(g)+2H2O(g)=4CO(g)+10H2(g) |
| D、3CH4(g)+O2(g)+H2O(g)=3CO(g)+7H2(g) |
某酯完全燃烧生成等物质的量的CO2和H2O,如该酯水解可得羧酸B和醇C,把醇C氧化可得羧酸D.且B与D互为同分异构体,则该酯可能为( )
| A、CH3CH2CH2COOCH2CH(CH3)2 |
| B、CH3 COOCH(CH3)2 |
| C、CH3 COOCH2CH2CH2OOCCH3 |
| D、CH3 COOCH2CH3 |
下列有关银镜反应实验的说法中不正确的是( )
| A、实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤 |
| B、向2%的硝酸银溶液中滴入2%的稀氨水液直到生成的沉淀恰好溶解为止 |
| C、可采用水浴加热,也可直接加热 |
| D、可用稀硝酸洗去试管内的银镜 |
某烃的结构简式为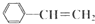 ,它可能具有的性质是( )
,它可能具有的性质是( )
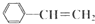 ,它可能具有的性质是( )
,它可能具有的性质是( )| A、能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
| B、与足量氢气反应生成苯乙烷 |
C、能发生加聚反应,生成物可用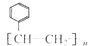 表示 表示 |
| D、易溶于水,也易溶于有机溶剂 |
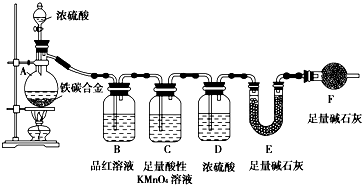 现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置: