题目内容
3.下列关于热化学反应的描述中正确的是( )| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H=-283.0 kJ/mol | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
分析 A.生成硫酸钙放热;
B.合成氨为放热反应,热化学方程式中为完全转化的能量变化;
C.1molCO完全燃烧放出的热量为燃烧热;
D.吸热反应与放热反应与反应条件无关.
解答 解:A.生成硫酸钙放热,则HCl和NaOH反应的中和热△H=-57.3kJ/mol,则测定的H2SO4和Ca(OH)2反应的中和热小于2×(-57.3)kJ/mol,故A错误;
B.合成氨为放热反应,热化学方程式中为完全转化的能量变化,由0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,可知热化学方程式为:N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$2NH3(g)△H<-38.6kJ•mol-1,故B错误;
C.1molCO完全燃烧放出的热量为燃烧热,则表示CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H=-283.0 kJ/mol,故C正确;
D.吸热反应与放热反应与反应条件无关,常温下发生的反应可能为吸热反应,如氢氧化钡与氯化铵的反应,故D错误;
故选C.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、中和热与燃烧热为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
相关题目
19.化学与生产、生活、社会发展息息相关.下列说法正确的是( )
| A. | 食品包装时放入盛有还原铁粉的透气小袋可防止食品氧化变质 | |
| B. | 聚乙烯、聚氯乙烯均可作为包装材料,且不会造成环境污染 | |
| C. | 华为自主研发的“麒麟”芯片与光导纤维是同种材料 | |
| D. | 小苏打能作焙制蛋糕的膨松剂是由于小苏打能与碱反应生成CO2 |
14.下列关于胶体的叙述中正确的是( )
| A. | 胶体是一种液态混合物,属于分散系的一种 | |
| B. | 用丁达尔效应可区分Fe(OH)3胶体、水、CuSO4溶液 | |
| C. | 用过滤器可以将胶体和溶液分开 | |
| D. | 胶体的本质特征是发生丁达尔效应 |
18.下列实验操作中错误的是( )
| A. | 实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
8.下列各项中的两组反应都是在溶液中进行的,它们不能用同一离子方程式表示的是( )
| A. | HCl+Zn,Zn+NaHSO4 | B. | Cu(OH)2+H2SO4,Cu(OH)2+HNO3 | ||
| C. | CaO+HCl,CaO+HNO3 | D. | BaCl2+NaHSO4,Ba(OH)2+NaHSO4(少量) |
15.实验室中从溴水中提取溴,应采用的操作方法是( )
| A. | 过滤 | B. | 蒸发 | C. | 蒸馏 | D. | 萃取 |
12.下列说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 与金属反应时,稀HNO3被还原为NO,而浓HNO3被还原为NO2,故稀硝酸的氧化性强于浓硝酸 | |
| D. | 用10 mL量筒量取9.2 mL NaCl溶液 |
13.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.
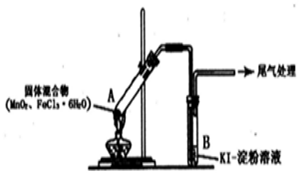
实验操作和现象如表:
回答下列问题:
(l)上述实验中的白雾是盐酸小液滴;试管A管口向上倾斜的原因是试管A中部分固体溶解在FeCl3•6H2O分解生成的水中形应溶液
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI一淀粉溶液变蓝的离子方程式:2Fe3++2I-=2Fe2++I2
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色.
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+.则方案1C中盛放的试剂是饱和NaCl溶液;方案2中检验Fe2+的试剂是铁氰化钾溶液,选择NaBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2.
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;其尾气处理的方法是将尾气通入到氢氧化钾溶液中.
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:实验未先赶出空气,其中的O2在此条件下可能氧化I-.请你设计实验方案验证此猜想:向一试管中加入KI-淀粉溶液.再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝.

实验操作和现象如表:
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示加热MnO2与FeCl3•6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把A中的混合物换为FeC13•6H2O,B中溶液换为KSCN溶液,加热. | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
(l)上述实验中的白雾是盐酸小液滴;试管A管口向上倾斜的原因是试管A中部分固体溶解在FeCl3•6H2O分解生成的水中形应溶液
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI一淀粉溶液变蓝的离子方程式:2Fe3++2I-=2Fe2++I2
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色.
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+.则方案1C中盛放的试剂是饱和NaCl溶液;方案2中检验Fe2+的试剂是铁氰化钾溶液,选择NaBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2.
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;其尾气处理的方法是将尾气通入到氢氧化钾溶液中.
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:实验未先赶出空气,其中的O2在此条件下可能氧化I-.请你设计实验方案验证此猜想:向一试管中加入KI-淀粉溶液.再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝.
 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空: