题目内容
短周期主族元素W、X、Y、Z位于同一周期,且原子序数依次增大.W、X是金属元素,Y、Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应,Y的最外层电子数是核外电子层数的2倍.下列说法正确的是( )
| A、W2Y溶液显中性 |
| B、W与Z形成的化合物中不含有离子键 |
| C、1mol元素Z的单质与足量的W的最高价氧化物对应的水化物的溶液反应,转移1mol电子 |
| D、W、X的单质通常是电解其氧化物得到 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:W、X是金属元素,W、X的最高价氧化物对应的水化物应为碱,可以相互反应,说明一种为两性氧化物,应为Al(OH)3,则W为Na,X为Al,Y的最外层电子数是核外电子层数的2倍,且与Na、Al在同一周期,应为S元素,Z的原子序数最大,主族元素,只有Cl元素符合,结合元素周期律的递变规律解答该题.
解答:
解:W、X是金属元素,W、X的最高价氧化物对应的水化物应为碱,可以相互反应,说明一种为两性氧化物,应为Al(OH)3,则W为Na,X为Al,Y的最外层电子数是核外电子层数的2倍,且与Na、Al在同一周期,应为S元素,Z的原子序数最大,主族元素,只有Cl元素符合,则
A.Na2S为强碱弱酸盐,水解呈碱性,故A错误;
B.W与Z形成的化合物为NaCl,含有离子键,故B错误;
C.1mol元素Z的单质与足量的W的最高价氧化物对应的水化物的溶液反应,反应为Cl2+2NaOH=NaCl+NaCl+H2O,转移1mol电子,故C正确;
D.工业常用电解熔融的NaCl制备钠,故D错误.
故选C.
A.Na2S为强碱弱酸盐,水解呈碱性,故A错误;
B.W与Z形成的化合物为NaCl,含有离子键,故B错误;
C.1mol元素Z的单质与足量的W的最高价氧化物对应的水化物的溶液反应,反应为Cl2+2NaOH=NaCl+NaCl+H2O,转移1mol电子,故C正确;
D.工业常用电解熔融的NaCl制备钠,故D错误.
故选C.
点评:本题考查位置结构性质的关系及应用,题目难度中等,氢氧化铝性质的角度作为该题的突破口,注意把握原子核外电子排布特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、滴定用的锥形瓶和滴定管都要用所盛溶液润洗 |
| B、配制一定物质的量浓度的溶液时,所用的容量瓶要预先干燥 |
| C、乙醇、乙酸、乙酸乙酯三种液体可用饱和Na2CO3溶液鉴别 |
D、如图装置可用于分离沸点不同的液体混合物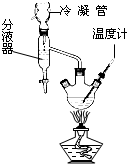 |
将17.6克Fe2O3和Cu的混合物溶解于足量的稀盐酸中,再加铁粉9.8克,待铁粉溶解后,溶液中无Fe3+,此过程共产生2.24升H2(标况),则下列判断正确的是( )
| A、混合物中Cu全部被氧化为Cu2+以后,Cu2+又全部被还原 |
| B、混合物中Cu全部被氧化为Cu2+以后,Cu2+又部分被还原 |
| C、混合物中Cu部分被氧化为Cu2+以后,Cu2+又全部被还原 |
| D、混合物中Cu部分被氧化为Cu2+以后,Cu2+又部分被还原 |
下列各离子浓度的大小比较,正确的是( )
| A、0.2 mol?L-1 Na2CO3溶液中:c (OH-)=c (HCO3-)+c (H+)+c (H2CO3) |
| B、常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl-) |
| C、同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3?H2O,c(NH4+)由大到小的顺序是:①>③>②>④ |
| D、含有NH4+、Cl-、OH-、H+的溶液中,离子浓度一定是c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
NaOH溶液滴定盐酸实验中,不必用到的是( )
| A、酚酞 | B、圆底烧杯 |
| C、锥形瓶 | D、碱式滴定管 |
X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2和RY3,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时0.01mol?L-1 X和W形成化合物的水溶液pH为2,下列说法正确的是( )
| A、非金属性Y>R,则Y的最高价氧化物水化物的酸性高于R的最高价氧化物水化物的酸性 |
| B、在Z、Y形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 |
| C、原子半径由大到小排列的是:Z>R>W>Y>X |
| D、Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
我国科学家研制出一种催化剂,它能在室温下高效催化使空气中甲醛被氧化,其反应如下:HCHO+O2
CO2+H2O.下列有关说法正确的是( )
| 催化剂 |
| A、该反应为吸热反应 |
| B、HCHO分子是一种极性分子 |
| C、CO2分子中的化学键为非极性键 |
| D、每生成44g CO2消耗22.4L O2 |
有机化合物X的结构简式为 .有关X的叙述不正确的是( )
.有关X的叙述不正确的是( )
 .有关X的叙述不正确的是( )
.有关X的叙述不正确的是( )| A、X的分子式为C11H12O2 |
| B、1mol X最多能与4mol H2发生加成反应 |
| C、X能与热的新制氢氧化铜悬浊液反应,生成红色沉淀 |
| D、在一定条件下,X可以发生取代、氧化、酯化反应 |
已知2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1,2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1.下列说法正确的是( )
| A、1molH2O(l)变成1mo1H2O(g),吸收88 kJ能量 |
| B、1 molH2O(g)分解成H2(g)和O2(g),吸收241.8kJ能量 |
| C、2 molH2(g)和1molO2(g)的总能量小于2molH2O(l)的能量 |
| D、可以寻找特殊催化剂使H2O分解,同时放出能量 |