题目内容
11.化合物H是一神著名的香料,某研宂小组从苯出发,经两条路线合成化合物H,其中化合物D的分子式为C7H8
已知:
I.RX+Mg$\stackrel{无水乙醚}{→}$RMgX(X为卤素原子)
Ⅱ.RMgX+
 →R-CH2CH2OMgX<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>→H2O/H+$\stackrel{H_{2}O/H+}{→}$R-CH2CH2OH
→R-CH2CH2OMgX<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>→H2O/H+$\stackrel{H_{2}O/H+}{→}$R-CH2CH2OHⅢ.RMgX+
 →
→ $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$
请回答:
(1)下列说法不正确的是A、D
A.常温下,化合物A为褐色、密度比水大的液体
B.化合物C能发生消去反应
C.化合物D的一氯代物有4种
D.化合物E能发生水解反应和消去反应
(2)苯→D的化学方程式是
 +CH3Br$→_{.}^{AlBr_{3}}$
+CH3Br$→_{.}^{AlBr_{3}}$ +HBr
+HBr(3)G的结构简式是

(4)写出同时符合下列条件的C的所有同分异构体的结构简式
 ,
,
①能与FeCl3溶液发生显色反应:
②1H-NMR谱显示分子中含有四种不同环境的氢原子
(5)设计以C和丙酮为原料制备H的合成路线.(无机试剂任选,且不超过四步)
提示:合成路线的书写格式参照如下示例流程图:CH3CH2OH<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>→170℃浓硫酸$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$BrH2CCH2Br.
分析 分析流程图,先看上面一条流程图:苯与Br2在催化剂FeBr3下发生取代反应,生成A ,
, 与金属Mg在无水乙醚的条件下(见已知条件I)生成格氏试剂B
与金属Mg在无水乙醚的条件下(见已知条件I)生成格氏试剂B ,格式试剂与环氧乙烷在酸性条件(见已知条件II)发生开环反应,并水解,生成醇类C
,格式试剂与环氧乙烷在酸性条件(见已知条件II)发生开环反应,并水解,生成醇类C
,然后经过一系列反应生成最终产物;再看下面一条流程图,苯与CH3Br在路易斯酸AlBr3催化作用下(题干中指出D的分子式为C7H8)发生傅-克烷基化反应,生成D
,D在光照下与Cl2发生自由基取代反应,取代甲基氢上的一个H原子,生成E ,E与金属M在无水乙醚条件下(见已知条件I)生成格氏试剂F
,E与金属M在无水乙醚条件下(见已知条件I)生成格氏试剂F ,并在酸性条件下水解(见已知条件II)并与
,并在酸性条件下水解(见已知条件II)并与 反应生成产物H.
反应生成产物H.
解答 解:(1)A.常温下,化合物A为溴苯,为无色油状液体,密度比水大,故A错误;
B.化合物C为 ,含有β-H,能发生消去反应,故B正确;
,含有β-H,能发生消去反应,故B正确;
C.化合物D为 ,一氯代物有取代甲基的,苯环上邻位,间位,对位均可以,共有4种,故C正确;
,一氯代物有取代甲基的,苯环上邻位,间位,对位均可以,共有4种,故C正确;
D.化合物E为 ,不能发生消去反应,能发生水解反应,故D错误.
,不能发生消去反应,能发生水解反应,故D错误.
故选AD.
(2)苯生成D的化学反应方程式为: +CH3Br$→_{.}^{AlBr_{3}}$
+CH3Br$→_{.}^{AlBr_{3}}$ +HBr.
+HBr.
故答案为: +CH3Br$→_{.}^{AlBr_{3}}$
+CH3Br$→_{.}^{AlBr_{3}}$ +HBr.
+HBr.
(3)根据已知条件II可知,化合物G应为环氧化物,据此推断,G的结构简式应为 .故答案为:
.故答案为: .
.
(4)C为 ,其同分异构体符合条件:①能与FeCl3显色,表明含有酚羟基,.1H-NMR图谱上显示分子含有四种不同环境的氢原子,表明含有4种不同化学环境的氢,符合这两个条件的同分异构体有:
,其同分异构体符合条件:①能与FeCl3显色,表明含有酚羟基,.1H-NMR图谱上显示分子含有四种不同环境的氢原子,表明含有4种不同化学环境的氢,符合这两个条件的同分异构体有: ,
, .故答案为:
.故答案为:
 .
.
(5)以C 和丙酮为原料合成化合物H,结合流程图已有反应过程,和已知条件过程,可考虑设计路线为:
和丙酮为原料合成化合物H,结合流程图已有反应过程,和已知条件过程,可考虑设计路线为:


 .
.
故答案为:


 .
.
点评 本题考查有机化学的基本知识,有机合成与推断,同分异构体的书写,有机化学反应的书写,注意中间用箭头连接.题目难度中等,是中档题.

| A. | 煤气的主要成分是甲烷 | |
| B. | 若0.2mol某烃在O2中充分燃烧时,生成水和CO2各1.2mol,则该烃为苯 | |
| C. | 乙烯能使溴水和酸性高锰酸钾溶液褪色,其褪色原理不同 | |
| D. | 煤的干馏属于化学变化,而煤的液化和气化属于物理变化 |
 性质叙述正确的是( )
性质叙述正确的是( )| A. | 1 mol该有机物可以与3 mol Na发生反应 | |
| B. | 1 mol该有机物可以与3 mol NaOH发生反应 | |
| C. | 1 mol该有机物可以与6 mol H2发生加成反应 | |
| D. | 1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |
| A. | 电池的电解液为碱性溶液 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 放电时Ni2O3在正极被氧化 | |
| D. | 电池放电时,OH-往负极移动 |
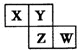 X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素:在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )| A. | X、Y、Z的原子半径大小:X>Y>Z | |
| B. | Y、Z的气态氢化物的热稳定性:Y<Z | |
| C. | Z、W的最高价氧化物对应水化物的酸性:Z<W | |
| D. | X、W的气态氢化物相互反应,生成物中既含离子键又含极性键和非极性键 |
| 选项 | 操作 | 主要仪器 |
| A | 称取3.0g干海带 | 托盘天平 |
| B | 灼烧干海带至完全变成灰烬 | 烧杯 |
| C | 过滤煮沸后的海带灰与水的混合液 | 漏斗 |
| D | 用四氯化碳从氧化后的海带灰浸取液中提取碘 | 分液漏斗 |
| A. | A | B. | B | C. | C | D. | D |