题目内容
工业上合成氨气,已知通入1mol N2和3mol H2,反应过程中共放出a kJ的热量.经测定反应中N2的转化率为20%(已知:N2的转化率=实际反应的N2的量/初始充入N2的总量),则合成氨气的热化学方程式可表示为( )
| A、N2(g)+3H2(g)?2NH3 (g)△H=a kJ/mol |
| B、N2(g)+3H2(g)?2NH3 (g)△H=-a kJ/mol |
| C、N2(g)+3H2(g)?2NH3 (g)△H=5a kJ/mol |
| D、N2(g)+3H2(g)?2NH3(g)△H=-5a kJ/mol |
考点:热化学方程式
专题:化学反应中的能量变化
分析:一定条件下,通入1mol N2和3mol H2,反应过程中共放出a kJ的热量.经测定反应中N2的转化率为20%,此时参加反应的氮气的物质的量为0.2mol,并放出akJ热量,则1mol氮气完全参加反应放热5aKJ,依据热化学方程式书写方法标注物质聚集状态和对应反应焓变;
解答:
解:N2(g)+3H2(g)?2NH3(g)△H
起始 1mol 3mol
变化 1mol×20% akJ
则1mol氮气完全参加反应放热=
×aKJ=5aKJ,反应放热△H<0,
则合成氨气的热化学方程式可表示为:N2(g)+3H2(g)?2NH3(g)△H=-5a kJ/mol,
故选D.
起始 1mol 3mol
变化 1mol×20% akJ
则1mol氮气完全参加反应放热=
| 1mol |
| 0.2mol |
则合成氨气的热化学方程式可表示为:N2(g)+3H2(g)?2NH3(g)△H=-5a kJ/mol,
故选D.
点评:本题考查热化学方程式的书写,注意掌握热化学方程式的书写,注意物质聚集状态和对应反应焓变,题目难度不大.

练习册系列答案
相关题目
 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是( )
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是( )| A、该反应的△H>0 | ||
| B、其他条件不变,升高温度反应的平衡常数增大 | ||
C、300℃时,0-t1min内CH3OH的平均生成速率为
| ||
D、A点的反应体系从300℃升高到500℃,达到平衡时
|
下列离子或分子在溶液中能大量共存,通入CO2 后仍能大量共存的一组是( )
| A、K+、Ca2+、Cl-、NO3- |
| B、K+、Na+、Br-、SiO32- |
| C、H+、Fe2+、SO42-、NO3- |
| D、K+、Ag+、NH3?H2O、NO3- |
下列关于离子检验的和气体除杂方法正确的是( )
| A、CO2中含混有HCl气体,可用饱和氯化钠溶液除杂 | ||
B、某溶液
| ||
| C、CO2中含混有SO2气体,可用饱和碳酸钠溶液除杂 | ||
D、某溶液
|
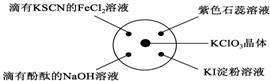 已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )