题目内容
某研究性学习小组探究铁粉与水蒸气反应后的固体的组成,铁粉与水蒸气反应的化学方程式为 .
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析.
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究.
探究1:取少量样品投入硫酸铜稀溶液中,若现象为 ,则假设一成立.
探究2:取1.68g样品在纯氧中灼烧后,若质量为 g,则假设二成立.
经过实验探究,假设一、二都不成立.
探究3:取样品4.00g进行如图实验.
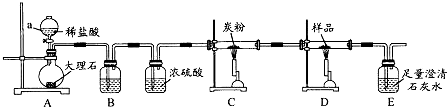
B中的溶液是 ;实验后经测定样品完全反应,D中剩余固体质量为3.36g,且测得E中沉淀质量为6.0g,则样品中Fe3O4的质量分数为 ;实验装置中有一明显缺陷是 .
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析.
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究.
探究1:取少量样品投入硫酸铜稀溶液中,若现象为
探究2:取1.68g样品在纯氧中灼烧后,若质量为
经过实验探究,假设一、二都不成立.
探究3:取样品4.00g进行如图实验.

B中的溶液是
考点:铁及其化合物的性质实验
专题:几种重要的金属及其化合物
分析:铁粉和水蒸汽之间发生的反应为:3Fe+4H2O(g)
Fe3O4+4H2,根据假设一和假设二来确定假设三的内容;
探究1:金属铁可以和硫酸铜溶液之间反应生成金属铜和硫酸亚铁,但是四氧化三铁和硫酸铜溶液之间不反应;
探究2:金属铁可以和氧气之间反应,但是四氧化三铁和氧气之间不反应;
探究3:碳酸钙和盐酸之间反应制取二氧化碳中混有氯化氢,可以用碳酸氢钠来除去,再用浓硫酸吸收水,二氧化碳可以和单质碳在高温下发生反应得到还原性的气体一氧化碳,一氧化碳可以和铁的氧化物发生还原反应得到金属铁,根据固体质量差量法来计算即可.
| ||
探究1:金属铁可以和硫酸铜溶液之间反应生成金属铜和硫酸亚铁,但是四氧化三铁和硫酸铜溶液之间不反应;
探究2:金属铁可以和氧气之间反应,但是四氧化三铁和氧气之间不反应;
探究3:碳酸钙和盐酸之间反应制取二氧化碳中混有氯化氢,可以用碳酸氢钠来除去,再用浓硫酸吸收水,二氧化碳可以和单质碳在高温下发生反应得到还原性的气体一氧化碳,一氧化碳可以和铁的氧化物发生还原反应得到金属铁,根据固体质量差量法来计算即可.
解答:
解:铁粉和水蒸汽之间发生的反应为:3Fe+4H2O(g)
Fe3O4+4H2,根据假设一:固体全部是Fe3O4 ;假设二:固体全部是Fe,
确定假设三:固体是Fe3O4 和Fe的混合物,
故答案为:3Fe+4H2O(g)
Fe3O4+4H2;Fe3O4 和Fe的混合物;
探究1:取少量样品投入硫酸铜稀溶液中,溶液无颜色变化.则一定不含金属铁,假设一成立,
探究2:金属铁可以和氧气之间反应,但是四氧化三铁和氧气之间不反应;
取1.68g样品在纯氧中灼烧后,存在金属铁时,则金属铁和氧气之间会反应:3Fe+2O2
Fe3O4,固体增加的是氧气的质量,
3Fe+2O2
Fe3O4,固体质量增加量
168 232 64g
1.68g 0.64g
所以当固体成分只有铁时,固体质量会增加0.64g,即质量为2.32g,此时假设二成立,
故答案为:2.32;
探究3:碳酸钙和盐酸之间反应制取二氧化碳中混有氯化氢,可以用碳酸氢钠来除去,再用浓硫酸吸收水,二氧化碳可以和单质碳在高温下发生反应得到还原性的气体一氧化碳,一氧化碳可以和铁的氧化物发生还原反应得到金属铁,E中沉淀碳酸钙质量为6.0g,CO2~CaCO3,则二氧化碳质量是2.64g,包括生成的还有原来和碳反应剩余的,
设:四氧化三铁的质量是x,
4CO+Fe3O4
3Fe+4CO2 固体质量变化量
232 168 (232-168)g
x (4-3.36)g
=
,解得x=2.32g,所以四氧化三铁的质量分数=
×100%=58%,反应有剩余的一氧化碳,有毒,要进行尾气处理,
故答案为:饱和碳酸氢钠溶液;58%;没有尾气处理装置,尾气中的CO将污染空气.
| ||
确定假设三:固体是Fe3O4 和Fe的混合物,
故答案为:3Fe+4H2O(g)
| ||
探究1:取少量样品投入硫酸铜稀溶液中,溶液无颜色变化.则一定不含金属铁,假设一成立,
探究2:金属铁可以和氧气之间反应,但是四氧化三铁和氧气之间不反应;
取1.68g样品在纯氧中灼烧后,存在金属铁时,则金属铁和氧气之间会反应:3Fe+2O2
| ||
3Fe+2O2
| ||
168 232 64g
1.68g 0.64g
所以当固体成分只有铁时,固体质量会增加0.64g,即质量为2.32g,此时假设二成立,
故答案为:2.32;
探究3:碳酸钙和盐酸之间反应制取二氧化碳中混有氯化氢,可以用碳酸氢钠来除去,再用浓硫酸吸收水,二氧化碳可以和单质碳在高温下发生反应得到还原性的气体一氧化碳,一氧化碳可以和铁的氧化物发生还原反应得到金属铁,E中沉淀碳酸钙质量为6.0g,CO2~CaCO3,则二氧化碳质量是2.64g,包括生成的还有原来和碳反应剩余的,
设:四氧化三铁的质量是x,
4CO+Fe3O4
| ||
232 168 (232-168)g
x (4-3.36)g
| 232-168 |
| 4-3.36 |
| 232 |
| x |
| 2.32g |
| 4.0g |
故答案为:饱和碳酸氢钠溶液;58%;没有尾气处理装置,尾气中的CO将污染空气.
点评:本题是一道关于铁以及化合物的性质实验探究题,注意实验能力的培养以及固体质量差量法的应用是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
除去下列物质中的杂质,所用试剂和方法均正确的是( )
| 物质 | 杂质 | 除杂所用试剂和方法 | |
| A | NaCl | CaCl2 | 通足量CO2、过滤 |
| B | KNO3 | K2SO4 | BaCl2溶液、过滤 |
| C | 碘 | H2O | 酒精、分液 |
| D | FeSO4 | CuSO4 | 加入过量铁屑、过滤 |
| A、A | B、B | C、C | D、D |
汽油蒸汽在发动机内和空气按一定比例混合,在电火花作用下燃烧,设汽油成分全部以辛烷计,空气中氧气占体积的
,下列说法正确的是( )
| 1 |
| 5 |
| A、排出废气中氮的氧化物含量多少与辛烷和空气的体积无关 |
| B、辛烷蒸气和空气的体积比大于2:125时,排出废气中氮的氧化物增多 |
| C、辛烷蒸气和空气的体积比等于2:125时,排出废气中不含一氧化碳和氮的氧化物 |
| D、辛烷蒸气和空气的体积比大于2:125时,排出废气中一氧化碳含量最多 |