题目内容
除去下列物质中的杂质,所用试剂和方法均正确的是( )
| 物质 | 杂质 | 除杂所用试剂和方法 | |
| A | NaCl | CaCl2 | 通足量CO2、过滤 |
| B | KNO3 | K2SO4 | BaCl2溶液、过滤 |
| C | 碘 | H2O | 酒精、分液 |
| D | FeSO4 | CuSO4 | 加入过量铁屑、过滤 |
| A、A | B、B | C、C | D、D |
考点:物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题
分析:A.CaCl2与CO2不反应;
B.会引入新的杂质;
C.酒精与水互溶;
D.CuSO4与Fe反应生成FeSO4和Cu.
B.会引入新的杂质;
C.酒精与水互溶;
D.CuSO4与Fe反应生成FeSO4和Cu.
解答:
解:A.CaCl2与CO2不反应,所以向溶液中通入二氧化碳不能除去NaCl中CaCl2,故A错误;
B.KNO3中含有K2SO4,加BaCl2溶液会生成硫酸钡和KCl,引入了新的杂质KCl,故B错误;
C.酒精与水互溶,用酒精不能萃取出碘水中的碘单质,故C错误;
D.在FeSO4和CuSO4溶液中加入过量铁屑,CuSO4与Fe反应生成FeSO4和Cu,过滤即可除去Cu和多余的Fe,所以能除去FeSO4中的杂质CuSO4,故D正确.
故选D.
B.KNO3中含有K2SO4,加BaCl2溶液会生成硫酸钡和KCl,引入了新的杂质KCl,故B错误;
C.酒精与水互溶,用酒精不能萃取出碘水中的碘单质,故C错误;
D.在FeSO4和CuSO4溶液中加入过量铁屑,CuSO4与Fe反应生成FeSO4和Cu,过滤即可除去Cu和多余的Fe,所以能除去FeSO4中的杂质CuSO4,故D正确.
故选D.
点评:本题考查了除杂质的实验方案设计,侧重于考查学生的实验探究能力,注意选择的除杂试剂不能引入新的杂质,题目难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
下列溶液中溶质的物质的量浓度为1mol/L的是( )
| A、将58.5g NaCl固体溶于1 L水中所得溶液 |
| B、将22.4L HCl气体溶于水配成1 L的溶液 |
| C、从1L 10mol/L的浓盐酸中取出的100mL溶液 |
| D、将4g NaOH固体溶于水中配成的100 mL溶液 |
关于KOH溶液和Fe(OH)3胶体描述正确的是( )
| A、两者的分散质都属于碱 |
| B、两者均为有色不透明的分散系 |
| C、两者分散质的直径都介于10-9~10-7m之间 |
| D、两者都有丁达尔效应 |
下列离子方程式书写正确的是( )
| A、碳酸氢钙溶液和过量氢氧化钙溶液混合:Ca2++2HCO3-+OH-═CaCO3↓+CO32-+H2O |
| B、CuCl2溶液与Na2S溶液2:1反应,Cu2++S2-═CuS↓ |
| C、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
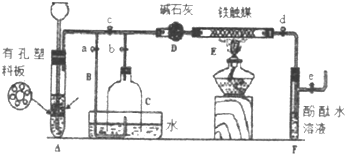
 某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.
某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.