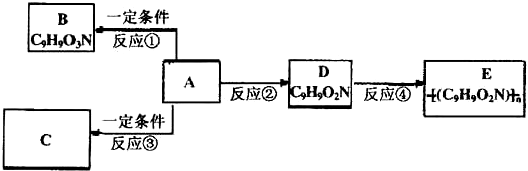
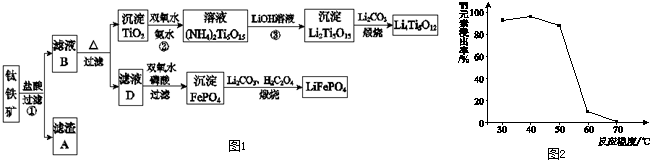
题目内容
pH=1的盐酸和pH=13的氨水等体积混合后,混合后溶液
(1)呈现 性(选择酸性碱性或中性)
(2)写出粒子浓度大小关系: .
(1)呈现
(2)写出粒子浓度大小关系:
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:pH=1的盐酸溶液中c(H+)=0.1mol/L,pH=13的氨水中c(OH-)=0.1moL/L,一水合氨为弱电解质,不能完全电离,氨水浓度较大,二者混合,氨水过量,溶液呈碱性,结合电荷守恒和物料守恒解答该题.
解答:
解:(1)pH=1的盐酸的浓度为0.1mol?L-1,而pH=13的氨水的浓度大于0.1 molL-1,
故等体积混合后氨水过量,溶液呈碱性,
故答案为:碱;
(2)混合液中有NH4Cl═NH4++Cl-①,NH3?H2O(过量的)?NH4++OH- ②,
①式中c(NH4+)=c(Cl-),
而溶液中c(NH4+)是①、②两式电离出的c(NH4+)之和,
故c(NH4+)>c(Cl-),又氨水过量溶液呈碱性故c(OH-)>c(H+),
而氨水为弱电解质,部分电离,故电离的c(OH-)一定小于c(Cl-),离子浓度大小c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+).
故等体积混合后氨水过量,溶液呈碱性,
故答案为:碱;
(2)混合液中有NH4Cl═NH4++Cl-①,NH3?H2O(过量的)?NH4++OH- ②,
①式中c(NH4+)=c(Cl-),
而溶液中c(NH4+)是①、②两式电离出的c(NH4+)之和,
故c(NH4+)>c(Cl-),又氨水过量溶液呈碱性故c(OH-)>c(H+),
而氨水为弱电解质,部分电离,故电离的c(OH-)一定小于c(Cl-),离子浓度大小c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+).
点评:本题考查酸碱混合的定性判断和离子浓度大小比较,为高频考点,侧重于学生的分析能力的考查,注意氨水为弱电解质的性质,从弱电解质的电离和盐类的水解的角度综合考虑解答该类题目,难度不大.

练习册系列答案
相关题目
关于KOH溶液和Fe(OH)3胶体描述正确的是( )
| A、两者的分散质都属于碱 |
| B、两者均为有色不透明的分散系 |
| C、两者分散质的直径都介于10-9~10-7m之间 |
| D、两者都有丁达尔效应 |
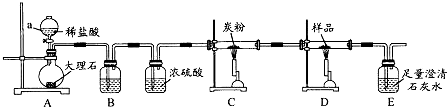
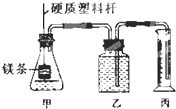 某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.
某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置. 某工厂排出的污水中含有大量的Fe3+、Zn2+、Hg2+三种金属离子.以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4?7H2O)和汞的方案.
某工厂排出的污水中含有大量的Fe3+、Zn2+、Hg2+三种金属离子.以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4?7H2O)和汞的方案.