题目内容
9.设NA为阿伏加德罗常数,下列说法中正确的是( )| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA | |
| C. | 28g乙烯所含共用电子对数目为4NA | |
| D. | 1mol甲基的电子数目为10NA |
分析 A、标况下戊烷为液体;
B、乙烯、丙烯和丁烯的最简式均为CH2;
C、求出乙烯的物质的量,然后根据乙烯中含6对共用电子对来分析;
D、甲基中含9个电子.
解答 解:A、标况下戊烷为液体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、乙烯、丙烯和丁烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含3mol原子即3NA个,故B正确;
C、28g乙烯的物质的量为1mol,而乙烯中含6对共用电子对,故1mol乙烯中含6NA对共用电子对,故C错误;
D、甲基中含9个电子,故1mol甲基中含9NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
19.关于化学平衡常数的叙述正确的是( )
| A. | 无论什么情况下,一个化学反应的平衡常数都是一个定值 | |
| B. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 化学平衡常数越大,反应速率越大 |
20.某有机物结构简式如图所示,下列关于该化合物的说法正确的是( )


| A. | 属于芳香族化合物 | |
| B. | 分子式为C27H42 | |
| C. | 核磁共振氢谱证明分子中的5个甲基上的氢原子化学环境相同 | |
| D. | 不能使酸性KMnO4溶液褪色 |
17.下列反应属于放热反应的是( )
| A. | C与水蒸气在高温下反应制取水煤气 | |
| B. | CO2与C在高温下进行反应 | |
| C. | 加热分解碳酸钙 | |
| D. | 钠与水的反应 |
4.在标准状态下,把一定体积的CO2气体通入200mL1mol•L-1Ca(OH)2的澄清石灰水中,充分反应,生成沉淀10g,则通入CO2气体体积的是( )
| A. | 1.12L | B. | 3.36L | C. | 4.48L | D. | 6.72L |
14.下列元素的原子半径依次减小的是( )
| A. | Na、Mg、Al | B. | N、P、As | C. | P、Si、Al | D. | C、Si、P |
18.氨的催化氧化法是工业生产中制取硝酸的主要途径,以下为其中的一步重要反应:
4H3(g)+5O2(g)?4NO(g)+6H2O(g)
下列条件下,反应速率最快的是( )
4H3(g)+5O2(g)?4NO(g)+6H2O(g)
下列条件下,反应速率最快的是( )
| 选项 | 温度 | 催化剂 | NH3(g)浓度 |
| A | 500℃ | 铂金合金网 | 2mol/L |
| B | 500℃ | 无 | 1mol/L |
| C | 800℃ | 铂铑合金网 | 2mol/L |
| D | 800℃ | 铂铑合金网 | 1mol/L |
| A. | A | B. | B | C. | C | D. | D |
14.相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ•mol-1.
实验测得起始、平衡时的有关数据如表所示:
下列叙述错误的是( )
N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ•mol-1.
实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 平衡时,两个容器中NH3的体积分数相等 | |
| C. | 若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ | |
| D. | 容器②中达平衡时放出的热量Q=23.15 kJ |
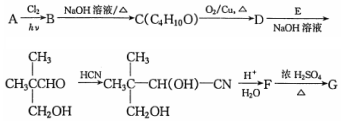
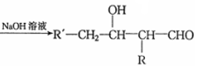
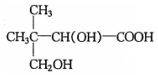 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$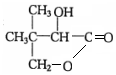 +H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为
+H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为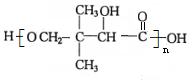 .
.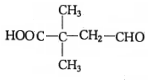 .
.