题目内容
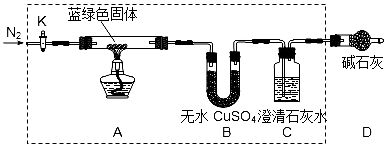
18.查资料得知有些硫酸盐在500℃以上开始按下式分解:硫酸盐$\stackrel{△}{→}$金属氧化物+SO2↑+SO3↑+O2↑有人猜测硫酸亚铁可能也是如此分解,并设计一验证性实验.(注:忽略气体吸收过程中的热效应)实验用到的仪器如图所示:
使用精密实验仪器,加热一段时间后,测得数据及有关结果如下:
Ⅰ、准确称取6.08g无水FeSO4;
Ⅱ、装置F总质量在实验结束时增加了0.16g,且其溶液中只有一种溶质;
Ⅲ、测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为112mL.
试回答下列问题:
(1)使用所有仪器,按装置从左至右的方向,各仪器接口连接顺序为:①⑨⑩⑥⑤③④⑧⑦②(填序号).
(2)装置F的作用是吸收SO3且产生等物质的量的SO2气体.
(3)装置C的作用是吸收SO2气体.
(4)本题测量气体体积时的注意事项是:
①视线要与凹液面最低点保持水平相切
②读数时BE两仪器内液面要相平.
③待气体冷却到室温时再读数.
(5)通过计算,推断出该条件下反应的化学方程式:8FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$4Fe2O3+6SO2↑+2SO3↑+O2↑.
分析 (1)猜测硫酸亚铁加热可能发生反应,硫酸盐$\stackrel{△}{→}$金属氧化物+SO2↑+SO3↑+O2↑,则固体受热分解连接顺序为试管中加热,根据气体的制备和收集按照发生装置→除杂装置→干燥气体→气体吸收装置→排水→测量装置来组装实验仪器;
(2)加热硫酸亚铁生成三氧化硫和氧气、二氧化硫、和氧化铁,因为装置F总质量在实验结束时增加了0.16g,且其溶液中只有一种溶质,所以三氧化硫通入饱和亚硫酸氢钠中发生反应生成硫酸氢钠和二氧化硫;
(3)装置C碱石灰吸收二氧化硫;
(4)测定气体体积时,应装置内气体的温度应恢复到室温,调节量筒使其液面与E装置中的液面持平,视线与液体的凹液面相平;
(5)1molSO3与1molSO2的质量差为16g,装置F总质量在实验结束时增加了0.16g,说明反应生成的SO3物质的量是0.01mol;最后测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为112mL即为氧气体积,故得到氧气0.005ml;6.08 g无水FeSO4的物质的量是$\frac{6.08g}{152g/mol}$=0.04mol,利用铁元素守恒得生成Fe2O3的物质的量是0.02mol;通过质量守恒即可计算生成SO2的物质的量是0.03mol.
解答 解:(1)气体的制备和收集按照发生装置→除杂装置→干燥气体→气体吸收装置→排水→测量装置来安装实验仪器,按从左至右的方向,先制备气体,通过亚硫酸氢钠吸收三氧化硫,再通过浓硫酸干燥二氧化硫气体和氧气,通过碱石灰吸收二氧化硫称量计算,最后利用排水量气法测定氧气的体积,各仪器接口连接顺序为:①⑨⑩⑥⑤③④⑧⑦②;
故答案为:⑥⑤、⑧⑦;
(2)加热硫酸亚铁生成三氧化硫和氧气、二氧化硫、和氧化铁,因为装置F总质量在实验结束时增加了0.16g,且其溶液中只有一种溶质,所以三氧化硫通入饱和亚硫酸氢钠中发生反应生成硫酸氢钠和二氧化硫,方程式为:SO3+NaHSO3=NaHSO4+SO2↑,所以亚硫酸氢钠的作用是吸收SO3并且产生等物质的量的SO2气体,故答案为:产生等物质的量的SO2气体;
(3)气体通过D装置后还剩二氧化硫和氧气,通过碱石灰吸收二氧化硫称量计算,所以装置C的作用是:吸收SO2气体,故答案为:吸收SO2气体;
(4)测定气体体积时,应装置内气体的温度应恢复到室温,调节量筒使其液面与E装置中的液面持平,由于量筒中液面是凹液面,所以读量筒中液体体积时,视线与液体的凹液面相平,否则会造成误差,
故答案为:与凹液面最低点保持水平相切;
(5)因为装置F中发生方程式为:SO3+NaHSO3=NaHSO4+SO2↑,则1molSO3与1molSO2的质量差为16g,装置F总质量在实验结束时增加了0.16g,说明反应生成的SO3物质的量是0.01mol;最后测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为112mL即为氧气体积,故得到氧气0.005ml;6.08 g无水FeSO4的物质的量是$\frac{6.08g}{152g/mol}$=0.04mol,利用铁元素守恒得生成Fe2O3的物质的量是0.02mol;通过质量守恒即可计算生成SO2的物质的量是$\frac{6.08-0.01×80-32×0.005-160×0.02}{64}$=0.03mol,反应方程式为:8FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$4Fe2O3+6SO2↑+2SO3↑+O2↑;
故答案为:8FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$4Fe2O3+6SO2↑+2SO3↑+O2↑.
点评 本题考查物质的组成和实验数据的处理,做题时注意把握实验基础知识,充分利用有关数据进行计算,本题具有一定难度.难点是确定硫酸亚铁的分解方程式的书写,注意碱石灰吸收的二氧化硫有部分是硫酸亚铁分解生成的、部分是三氧化硫和水、亚硫酸氢钠反应生成的二氧化硫,否则会导致计算错误.

 核心素养学练评系列答案
核心素养学练评系列答案| A. | CO2、CH4、N2等均是造成“温室效应”的气体 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 节能减排符合“低碳经济”的要求 | |
| D. | 合理开发利用“可燃冰”(固态甲烷水合物)有助于缓解能源紧缺 |
| A. | 1 mol H2O的质量为18g/mol | |
| B. | 11.2L氯气所含的分子数为0.5NA | |
| C. | 0.1mol/L的Na2CO3溶液中所含Na+的物质的量为0.2mol | |
| D. | 常温常压下,1mol氦气含有的核外电子数为2NA |
| A. | 32g | B. | 50g | C. | 72g | D. | 80g |
| A. | 16.25 | B. | 17.41 | C. | 15.51 | D. | 17.10 |
 某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题
某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题