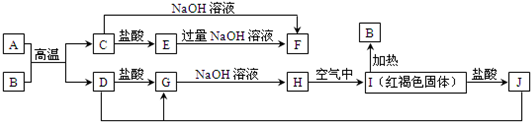
题目内容
10.甲醇质子交换膜燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.(1)101kPa时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ,则甲醇燃烧的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol;
(2)该电池的负极反应式为:CH3OH+H2O-6e-=CO2+6H+.
分析 (1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,以此书写热化学方程式;
(2)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳.
解答 解:(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,则燃烧的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol;
(2)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2+6H+,
故答案为:CH3OH+H2O-6e-=CO2+6H+.
点评 本题为综合题,涉及反应热的计算、热化学反应方程式的书写、燃料电池等知识点,注重高考常考考点的考查,题目难度中等.

练习册系列答案
相关题目
13.节能降耗,保护环境是可持续发展的主要课题.请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实验污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是BD;
A.制备环氧乙烷:2CH2=CH2+O2$\stackrel{催化剂}{→}$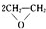
B.制备硫酸铜:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2$\frac{\underline{催化剂}}{△}$2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因在酸性条件下,CN-与H+结合生成毒性很强的HCN,对人和环境造成危害;
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因.
①从产率和产量角度分析虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
②从环境保护和能耗角度分析两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得.
(1)“绿色化学”的最大特点在于它是在始端就采用预防实验污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是BD;
A.制备环氧乙烷:2CH2=CH2+O2$\stackrel{催化剂}{→}$
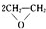
B.制备硫酸铜:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2$\frac{\underline{催化剂}}{△}$2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因在酸性条件下,CN-与H+结合生成毒性很强的HCN,对人和环境造成危害;
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
①从产率和产量角度分析虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
②从环境保护和能耗角度分析两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得.
14.欲将 转化为
转化为 ,可以加入( )
,可以加入( )
 转化为
转化为 ,可以加入( )
,可以加入( )| A. | 水 | B. | 碳酸氢钠溶液 | C. | 碳酸 | D. | 盐酸 |
20.NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下22.4L任意比的氢气和二氧化碳的混合气体中含有的分子总数均为NA | |
| B. | 0.1mol/LNaCl溶液中Na+的数目为0.1NA | |
| C. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| D. | 500mL0.2mol/L饱和FeCl3溶液完全转化可制得0.1NA个Fe(OH)3胶粒 |
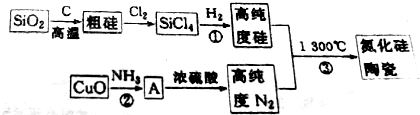
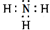 ,含有的化学键类型是极性共价键
,含有的化学键类型是极性共价键