题目内容
12.关于过氧化尿素[CO(NH2)2•H2O2]的说法不正确的是( )| A. | 组成元素都属于主族元素 | B. | 组成元素都属于非金属元素 | ||
| C. | 分子中只含有共价键 | D. | 分子中既含有共价键又含有离子键 |
分析 由化学式可知含C、H、O、N元素,只含共价键,以此来解答.
解答 解:A.四种元素均为主族元素,故A正确;
B.均为非金属元素,故B正确;
C.非金属元素之间形成共价键,故C正确;
D.该物质不含离子键,故D错误;
故选D.
点评 本题考查物质的组成及化学键,为高频考点,把握非金属元素之间形成共价键为解答的关键,侧重分析与应用能力的考查,注意不含铵根离子,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.设 NA 表示阿伏加德罗常数的数值,下列叙述中正确的是( )
| A. | 1 mol NH3所含有的电子数为 17NA | |
| B. | 常温常压下,22.4 L 氧气所含的原子数为 2NA | |
| C. | 常温常压下,48g O3 所含的氧原子数为 3NA | |
| D. | 1 mol/L NaCl 溶液中所含的 Na+数为 NA |
3.下列排列顺序不正确的是( )
| A. | 离子半径:Al3+<Mg2+<F-<O2- | B. | 热稳定性:SiH4>NH3>H2O>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
20.10mL某种气态烃,在50mL氧气中完全燃烧,得到液态水和体积为35mL的混合气体(所有气体体积都是在同温同压下测定),则下列烃中符合题意的烃是( )
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
17.高铁酸钾K2FeO4是一种高效、氧化性比Cl2更强的水处理剂,工业上常用下列反应先制高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在低温下,在Na2FeO4溶液中加KOH固体至饱和就可析出K2FeO4,下列有关说法不正确的是( )
| A. | Na2O2在反应中作氧化剂,又作还原剂 | |
| B. | 高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小 | |
| C. | K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮物 | |
| D. | 制取高铁酸钠时,每生成1mol Na2FeO4反应中共有4mol电子转移 |
4.表为周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述,正确的是( )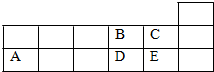

| A. | 它们的简单离子半径大小关系为:A>D>E>B>C | |
| B. | 氧化物的水化物的酸性强弱关系:E>D>A | |
| C. | 化合物E2B的分子中B原子的杂化方式为sp3 | |
| D. | 工业上将E单质通入澄清石灰水中反应制漂白粉 |
1.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A. | Fe3+、H+、SO42-、ClO- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、SO42-、CO32- | D. | K+、H+、Br-、MnO4- |
2.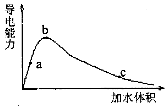 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的PH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的PH试纸上,测得PH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c |
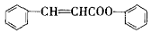 )是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
)是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
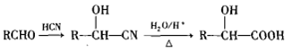
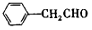 .
.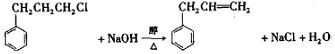 .
. .
. 或
或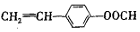 .(任写一种)
.(任写一种)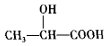 )的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
)的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).