题目内容
12. 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法不正确的是( )
意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法不正确的是( )| A. | N4晶体属于由非极性键构成的分子晶体 | |
| B. | 氮元素非金属性比磷强,可知N4沸点比P4(白磷)高 | |
| C. | lmol N4气体转变为N2气体放出888kJ热量 | |
| D. | N4与N2互为同素异形体 |
分析 A.同种元素之间形成的共价键为非极性键,不同元素的原子之间形成的共价键为极性键,N4分子中的化学键为N-N键,属于非极性键;
B.根据影响分子晶体的熔沸点高低的因素分析;
C.根据化学键断裂要吸收热量,形成化学键要放出热量,根据题中数据计算出1molN4转变成N2放出的热量;
D.N4和N2都是氮元素的不同单质,二者互为同素异形体.
解答 解:A.N4分子中存在N-N非极性键,其分子中不存在极性键,故A正确;
B.N4和P4都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,沸点越高,所以白磷的沸点高,故B错误;
C.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167kJ=1002kJ,形成化学键放出的热量为2×942kJ=1884kJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882kJ热量,故C正确;
D.N4和N2是同种元素形成的不同种单质,互为同素异形体,故D正确,故选B.
点评 本题考查较为综合,涉及物质的组成和分类、分子的极性、同素异形体与同分异构体的判断、反应热的计算,题目难度不大,注意基础知识的把握.

练习册系列答案
相关题目
3.下列实验操作正确的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,冷凝水应从冷凝管上口进,下口出 | |
| C. | 过滤时,用玻璃棒搅拌以加速过滤 | |
| D. | 用酒精萃取碘水中的碘 |
20.工业上曾经利用铝热反应焊接钢轨,现在高层建筑爆破中常用铝热反应来熔断钢筋.铝热反应方程式如下:2Al+Fe2O3=2Fe+Al2O3,对于该反应,下列说法正确的是( )
| A. | Fe是氧化剂 | B. | Fe2O3被还原 | ||
| C. | A1 发生了还原反应 | D. | Fe2O3失去电子 |
7.碘是一种重要的药用元素,缺乏碘能导致甲状腺肿大等.为预防碘缺乏病,目前我国的食盐都是“加碘食盐”.“加碘食盐”中加的是含碘元素的物质是碘酸钾(KIO3),KIO3属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
17.能充分说明反应P(g)+Q(g)═R(g)+S(g)在恒温下达到平衡状态的是( )
| A. | 容器内的压强不随时间而变化 | B. | 混合气体的密度不再随时间而变化 | ||
| C. | P和R的生成速率相等 | D. | 容器内P、Q、R、S共存 |
1.氟利昂-122的化学式是CF2Cl2,下面关于氟利昂-122的说法正确的是( )
| A. | 属于正四面体的空间结构 | B. | 对环境无污染 | ||
| C. | 没有同分异构体 | D. | 是甲烷的同系物 |
2.将足量铝投入到下列溶液中,固体质量会减小的是( )
①盐酸;②CuSO4溶液;③氢氧化钠溶液;④AgNO3溶液.
①盐酸;②CuSO4溶液;③氢氧化钠溶液;④AgNO3溶液.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
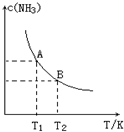 将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.
将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.