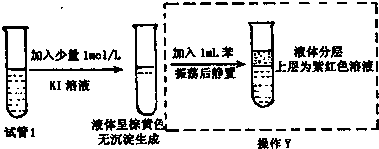
题目内容
新技术的开发离不开新材料,物质结构的研究为新材料的应用奠定了基础.2010、2011年的诺贝尔奖均与物质结构有关,其中2010年的诺贝尔物理学奖颁给了因在二维空间材料石墨烯方面进行了开创性实验的两位英国科学家.如图1是几种晶体的结构图示: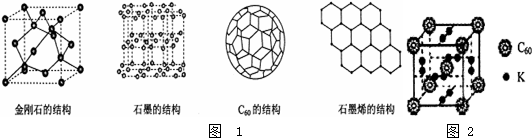
请回答有关问题:
(1)C的基态原子的电子排布式是: ;
(2)C60可用作储氢材料.已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为145-140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确? ,简述理由 ;
(3)石墨烯可用看做单层的石墨,所有的碳原子都以单键结合,每个碳原子多余的一个电子用于形成一种特殊的大п键,所以这些形成п键的电子可以在石墨烯中自由运动.下列关于石墨烯的说法不正确的是 ;
A.仅有一个碳原子的厚度,如此薄的结晶材料肯定是非常不稳定的
B.具有和金属一样良好的导电、导热性能
C.所有的碳原子均采用sp2杂化
D.由于碳碳原子间以共价键相结合,它的强度应该是非常高的
(4)已知石墨烯中每个碳碳键的键长为142pm,可以计算出平均每个正六边形的面积约为5.24×10-20m2,则12g石墨烯的面积约为 m2;
(5)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,该物质在低温时是一种超导体.其晶胞如图2所示,该物质中K原子核C60分子的个数比为 ;
(6)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 ;其中Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则每个Si60分子中п键的数目为 .

请回答有关问题:
(1)C的基态原子的电子排布式是:
(2)C60可用作储氢材料.已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为145-140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?
(3)石墨烯可用看做单层的石墨,所有的碳原子都以单键结合,每个碳原子多余的一个电子用于形成一种特殊的大п键,所以这些形成п键的电子可以在石墨烯中自由运动.下列关于石墨烯的说法不正确的是
A.仅有一个碳原子的厚度,如此薄的结晶材料肯定是非常不稳定的
B.具有和金属一样良好的导电、导热性能
C.所有的碳原子均采用sp2杂化
D.由于碳碳原子间以共价键相结合,它的强度应该是非常高的
(4)已知石墨烯中每个碳碳键的键长为142pm,可以计算出平均每个正六边形的面积约为5.24×10-20m2,则12g石墨烯的面积约为
(5)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,该物质在低温时是一种超导体.其晶胞如图2所示,该物质中K原子核C60分子的个数比为
(6)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是
考点:晶胞的计算,原子核外电子排布
专题:化学键与晶体结构
分析:(1)C为6号元素,核外有6个电子,根据核外电子排布规律排布;
(2)根据分子晶体的熔点与共价键的键能无关;
(3)A.石墨烯可以看做单层的石墨,所有的碳原子都以单键结合,在单层的石墨存在大π键,所以石墨烯的性质还是很稳定的;
B.由于在单层的石墨存在大π键,这些π键电子可以在石墨烯中自由运动,所以石墨烯具有和金属一样良好的导电、导热性能;
C.石墨烯中所有的碳原子都以单键结合,每个碳周围有三个碳,形成三个共价键,所以所有的碳原子均为sp2杂化;
D.由于石墨烯可以看做单层的石墨,在同一层内所有的碳原子都以单键结合,但层与层之间是范德华力,所以它的强度应当介于分子晶体和原子晶体之间;
(4)利用均摊法算出每个六边形实际占有碳原子的个数,再结合六边形的面积和碳原子的物质的量可以算得石墨烯的面积;
(5)根据电子排布规律,写出钾原子电子排布式;根据晶胞的分配原则计算出每个晶胞结构各离子的个数;
(6)根据同一周期,同一主族,元素电负性变化规律,比较元素电负性大小;根据每个硅原子最外层才满足8电子稳定结构,得出每个硅原子只有
个π键.
(2)根据分子晶体的熔点与共价键的键能无关;
(3)A.石墨烯可以看做单层的石墨,所有的碳原子都以单键结合,在单层的石墨存在大π键,所以石墨烯的性质还是很稳定的;
B.由于在单层的石墨存在大π键,这些π键电子可以在石墨烯中自由运动,所以石墨烯具有和金属一样良好的导电、导热性能;
C.石墨烯中所有的碳原子都以单键结合,每个碳周围有三个碳,形成三个共价键,所以所有的碳原子均为sp2杂化;
D.由于石墨烯可以看做单层的石墨,在同一层内所有的碳原子都以单键结合,但层与层之间是范德华力,所以它的强度应当介于分子晶体和原子晶体之间;
(4)利用均摊法算出每个六边形实际占有碳原子的个数,再结合六边形的面积和碳原子的物质的量可以算得石墨烯的面积;
(5)根据电子排布规律,写出钾原子电子排布式;根据晶胞的分配原则计算出每个晶胞结构各离子的个数;
(6)根据同一周期,同一主族,元素电负性变化规律,比较元素电负性大小;根据每个硅原子最外层才满足8电子稳定结构,得出每个硅原子只有
| 1 |
| 2 |
解答:
解:(1)C为6号元素,核外有6个电子,C的基态原子的电子排布式是1s22s22p2,故答案为:1s22s22p2;
(2)C60是分子晶体,熔化时破坏的是分子间作用力,金刚石是原子晶体,熔化时需破坏共价键,尽管C60中C-C键的键能可能大于金刚石,但其熔化时并不破坏化学键,因此比较键能没有意义,故答案为:否;C60是分子晶体,熔化时破坏的是分子间作用力,金刚石是原子晶体,熔化时需破坏共价键;
(3)A.石墨烯可以看做单层的石墨,所有的碳原子都以单键结合,在单层的石墨存在大π键,所以石墨烯的性质还是很稳定的,故A错误;
B.由于在单层的石墨存在大π键,这些π键电子可以在石墨烯中自由运动,所以石墨烯具有和金属一样良好的导电、导热性能,故B正确;
C.石墨烯中所有的碳原子都以单键结合,每个碳周围有三个碳,形成三个共价键,所以所有的碳原子均为sp2杂化,故C正确;
D.由于石墨烯可以看做单层的石墨,在同一层内所有的碳原子都以单键结合,但层与层之间是范德华力,所以它的强度应当介于分子晶体和原子晶体之间,故D正确;
故答案为:A;
(4)利用均摊法算出每个六边形实际占有碳原子的个数为6×
=2,所以,12g石墨烯(即1mol)实际占有的六边形的个数为
×6.02×1023,所以算得石墨烯的面积为
×6.02×1023×5.24×10-20=1.58×104m2,故答案为:1.58×104;
(5)在晶胞中,每个面上有两个钾原子,每个顶点上和体心有一个C60,根据均摊法可知K原子个数为6×22×
=6,C60分子的个数比为8×
+1=2;所以K原子个数为和C60分子的个数比为6:2=3:1,故答案为:3:1;
(6)同一周期,从左到右,电负性逐渐增大,同一主族,从上到下,电负性逐渐减小,因此,原子电负性由大到小的顺序是:N>C>Si,根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构.显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30,
故答案为:N>C>Si;30.
(2)C60是分子晶体,熔化时破坏的是分子间作用力,金刚石是原子晶体,熔化时需破坏共价键,尽管C60中C-C键的键能可能大于金刚石,但其熔化时并不破坏化学键,因此比较键能没有意义,故答案为:否;C60是分子晶体,熔化时破坏的是分子间作用力,金刚石是原子晶体,熔化时需破坏共价键;
(3)A.石墨烯可以看做单层的石墨,所有的碳原子都以单键结合,在单层的石墨存在大π键,所以石墨烯的性质还是很稳定的,故A错误;
B.由于在单层的石墨存在大π键,这些π键电子可以在石墨烯中自由运动,所以石墨烯具有和金属一样良好的导电、导热性能,故B正确;
C.石墨烯中所有的碳原子都以单键结合,每个碳周围有三个碳,形成三个共价键,所以所有的碳原子均为sp2杂化,故C正确;
D.由于石墨烯可以看做单层的石墨,在同一层内所有的碳原子都以单键结合,但层与层之间是范德华力,所以它的强度应当介于分子晶体和原子晶体之间,故D正确;
故答案为:A;
(4)利用均摊法算出每个六边形实际占有碳原子的个数为6×
| 1 |
| 3 |
| 1 |
| 2 |
| 1 |
| 2 |
(5)在晶胞中,每个面上有两个钾原子,每个顶点上和体心有一个C60,根据均摊法可知K原子个数为6×22×
| 1 |
| 2 |
| 1 |
| 8 |
(6)同一周期,从左到右,电负性逐渐增大,同一主族,从上到下,电负性逐渐减小,因此,原子电负性由大到小的顺序是:N>C>Si,根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构.显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30,
故答案为:N>C>Si;30.
点评:本题主要考查了晶体类型、电负性、电子排布式、分子的空间构型等,试题涉及的知识点较多,侧重于物质结构知识的综合考查,题目难度中等.

练习册系列答案
相关题目
将2.0molSO2气体和2.0molSO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为nmol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于nmol的是( )
| A、1.6molSO2+0.3molO2+0.4molSO3 |
| B、4.0molSO2+1.0molO2 |
| C、2.0molSO2+1.0molO2+2.0molSO3 |
| D、3.0molSO2+1.0molO2+1.0molSO3 |
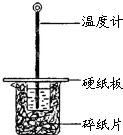 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )| A、该实验也可在保温杯中进行 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是保温、隔热,减少热量损失 |
| D、若将盐酸体积改为60 mL,两次实验所求得中和热不相等 |
常温下,有甲、乙两份体积为1L、浓度均为0.1mol.?L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释100倍后,溶液的pH变为x; ②乙与等体积、浓度为0.2mol?L-1的NaOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol.x、y的正确答案组合为( )
| A、3;0.1 |
| B、5;0.2 |
| C、3<x<5;0.1 |
| D、3<x<5;0.2 |
下列离子在溶液中能大量共存的是( )
| A、Na+、CO32-、SO42-、H+ |
| B、K+、OH-、H+、Cl- |
| C、Mg2+、H+、NO3-、SO42- |
| D、Fe3+、K+、OH-、NO3- |