题目内容
对已达平衡的反应2X(g)+Y(g)?4Z(g),改变以下哪种条件能使速率变化如图所示( )


| A、增大Z的浓度 |
| B、减小X的浓度 |
| C、增大压强 |
| D、减小压强 |
考点:化学平衡的影响因素,化学反应速率变化曲线及其应用
专题:化学平衡专题
分析:从图象分析,外界条件的改变,使正逆反应速率都增大,逆反应速率大于正反应速率,平衡逆向移动,据影响化学反应速率和影响平衡移动的因素综合考虑.
解答:
解:A、增大Z的浓度的瞬间,逆反应速率比原平衡大,正反应速率与原平衡相同,故A错误;
B、减小X的浓度,正反应速率比原平衡小,故B错误;
C、增大压强,正逆反应速率都比原平衡大,平衡逆向移动,故C正确;
D、减小压强,正逆反应速率都比原平衡小,平衡正向移动,正反应速率大于逆反应速率,故D错误;
故选C.
B、减小X的浓度,正反应速率比原平衡小,故B错误;
C、增大压强,正逆反应速率都比原平衡大,平衡逆向移动,故C正确;
D、减小压强,正逆反应速率都比原平衡小,平衡正向移动,正反应速率大于逆反应速率,故D错误;
故选C.
点评:本题考查了影响反应速率的因素和影响平衡移动的因素,注意用勒夏特列原理分析.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8gO2含有2nA个电子 |
| B、10L0.1mol?L-1的氨水中有nA个NH4+ |
| C、标准状况下,22.4L盐酸含有nA个HCl分子 |
| D、1molNa与足量氧气反应生成Na2O和Na2O2的混合物,失去nA个电子 |
若在1L蒸馏水中加入1滴(约0.05mL)0.1mol?L-1的NaCl溶液,搅拌均匀后再滴入1滴0.1mol?L-1 AgNO3溶液是否会产生沉淀(已知AgCl的Ksp=1.8×10-10)( )
| A、否 | B、是 |
| C、可能是 | D、以上都不正确 |
已知常温下:
KSP[Mg(OH)2]=1.2×10-11mol3?L-3
KSP(AgCl)=1.8×10-10mol2?L-2
KSP(Ag2CrO4)=1.9×10-12mol3?L-3
KSP(CH3COOAg)=2.3×10-3mol-2?L-2
下列叙述正确的是( )
KSP[Mg(OH)2]=1.2×10-11mol3?L-3
KSP(AgCl)=1.8×10-10mol2?L-2
KSP(Ag2CrO4)=1.9×10-12mol3?L-3
KSP(CH3COOAg)=2.3×10-3mol-2?L-2
下列叙述正确的是( )
| A、等体积混合浓度均为0.2mol/L的AgNO3溶液和CH3COONa溶液不一定产生CH3COOAg沉淀 |
| B、将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀 |
| C、在Mg2+为0.12mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上 |
| D、向饱和AgCl水溶液中加入NaCl溶液,KSPAgCl变大 |
把下列四种X溶液分别加入四个盛有10mL2mol?L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸发生反应,其中反应速率最快的是( )
| A、10℃20mL3mol?L-1的X溶液 |
| B、20℃30mL2mol?L-1的X溶液 |
| C、20℃10mL4mol?L-1的X溶液 |
| D、10℃10mL2mol?L-1的X溶液 |
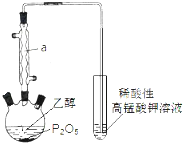 已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃.某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去).
已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃.某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去).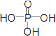 )
)
 CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2 某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.
某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.