题目内容
11.几种短周期元素的原子半径及主要化合价见表:| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R的单质与稀盐酸反应速率L<R | |
| B. | M与T形成的化合物有两性 | |
| C. | Q、T两元素的氢化物分子间都存在氢键 | |
| D. | L、Q形成的简单离子核外电子数相等 |
分析 因元素的最高正价=最外层电子数=主族元素的族序数,最高正价和最低负价绝对值的和为8,同主族从上到下原子半径逐渐增大,Q、T两元素最外层电子数为6,为第ⅥA元素,Q的半径大于T,所以在周期表中T为O,Q为S;L、R元素最外层电子数为2,为第ⅡA元素,且半径与L比R大,所以L为Mg、R为Be;M最外层电子数为3,为第ⅢA元素,且半径与L相差较小,同周期元素原子半径从左到右依次减小,所以M与L在同一周期,故M为Al,据此结合元素周期律知识进行解答.
解答 解:因元素的最高正价=最外层电子数=主族元素的族序数,最高正价和最低负价绝对值的和为8,同主族从上到下原子半径逐渐增大,Q、T两元素最外层电子数为6,为第ⅥA元素,Q的半径大于T,所以在周期表中T为O,Q为S;L、R元素最外层电子数为2,为第ⅡA元素,且半径与L比R大,所以L为Mg、R为Be;M最外层电子数为3,为第ⅢA元素,且半径与L相差较小,同周期元素原子半径从左到右依次减小,所以M与L在同一周期,故M为Al元素,
A.金属性Mg>Be,元素的金属性越强,对应的单质与盐酸反应的越剧烈,即L、R的单质与稀盐酸反应速率L>R,故A错误;
B.M与T形成的化合物为氧化铝,氧化铝为两性氧化物,故B正确;
C.Q、T分别为O、S元素,两元素对应氢化物分别为水、硫化氢,水分子中存在氢键,而硫化氢中不存在氢键,故C错误;
D.L(Mg)形成的简单离子核外有2个电子层,Q(S)形成的简单离子核外有3个电子层,核外电子不相等,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意明确元素周期律的递变规律,试题培养了学生的分析能力及逻辑推理能力.

 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | 黏土 | B. | 纯碱 | C. | 石灰石 | D. | 石英(SiO2) |
| A. | 0.1 mol•L-1的“铅糖”溶液中c(Pb2+)<0.1 mol•L-1 | |
| B. | “铅糖”是强电解质 | |
| C. | “铅糖”是共价化合物 | |
| D. | “铅糖”的溶液可能不导电 |
| A. | 维生素C中氢的质量分数约为4.5% | |
| B. | 0.352g该试样中氧元素的质量为0.192g | |
| C. | 利用该实验所得数据计算可得维生素C的分子式为C3H4O3 | |
| D. | 维生素C是一种抗氧化剂,俗称抗坏血酸,它在中性或碱性溶液中易被氧化 |
| A. | 将氯气通入氢氧化钡溶液中:Cl2+2 OH-=H2O+Cl-+ClO- | |
| B. | 贝壳溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 铁与FeCl3溶液反应:Fe+Fe3+=2Fe2+ | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++OH -+H++SO42-=BaSO4↓+H2O |
| A. | Fe与盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 氯气与H2O反应 Cl2+H2O═Cl-+2H++ClO- | |
| D. | 过量的CO2与Ca(ClO)2溶液反应:CO2+ClO-+H2O═HClO+HCO3- |
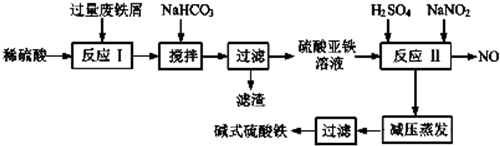
已知部分阳离子以氧氧化物形式沉淀时溶液的pH如下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
(1)加入过量废铁屑的目的是使铁离子充分被还原为亚铁离子,同时防止亚铁离子被空气中氧气氧化(用离子方程式表示);加入少量NaHCO3的目的是Al3++3HCO3-=Al(OH)3↓+3CO2↑;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,该流程中可以循环、回收利用的物质是NO;
(3)生产碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检测所得产品中是否含有Fe2+,应使用的试剂A.(填写字母)
| A.酸性KMnO4溶液 B.KSCN溶液 | C.氯水 D.NaOH溶液. |
 .
.