题目内容
16.按要求填写下列问题:(1)在常温下,将体积为VaL、pH为a的稀硫酸和体积为VbL、pH为b的烧碱溶液混合,若所得混合液为中性.如果a+b=15,则Va:Vb=10:1.
某温度时,水的离子积常数Kw=1×10-13.在此温度下,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,如果a+b=12,则Va:Vb=1:10.
(2)中和相同体积,相同pH的Ba(OH)2、NH3•H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为V2>V3=V1(用“V1、V2、V3”和“>、<、=”表示).
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同pH的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是b>a=c.(填酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是b=a=c,反应所用时间长短关系是a=c>b.
分析 (1)在常温下,有体积为Va升、pH值为a的稀硫酸和体积为Vb升,pH值为b的烧碱溶液混和,若所得混合液为中性.说明氢离子和氢氧根离子前后反应,得到:
Va×10-a=Vb×$\frac{1{0}^{-14}}{1{0}^{-b}}$,如果a+b=15,计算得到Va:Vb;
根据该温度下水的离子积计算出氢氧化钠的浓度、硫酸中氢离子浓度,然后根据反应后溶液显示中性计算出两溶液的体积之比;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,然后结合酸碱中和时c(OH-)越大,消耗酸越多;
(3)①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,酸中氢离子的物质的量与生成二氧化碳的体积成正比;
②反应速率与氢离子浓度成正比;酸中氢离子浓度越大,反应速率越快,反应时间越短,反应过程中醋酸不断电离.
解答 解:(1)体积为Va升、pH值为a的稀硫酸和体积为Vb升,pH值为b的烧碱溶液混和,若所得混合液为中性.说明氢离子和氢氧根离子前后反应,得到:
Va×10-a=Vb×$\frac{1{0}^{-14}}{1{0}^{-b}}$,如果a+b=15,计算得到Va:Vb =10-14+a+b=10-10=10:1;
某温度时,水的离子积常数Kw=1×10-13.在此温度下,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,如果a+b=12,则Va:Vb =10-13+a+b=10-10=1:10;
故答案为:1:10;1:10;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V3,
但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V3<V2,
所以消耗酸的体积关系为:V3>V2=V1,
故答案为:V2>V3=V1;
(3)醋酸和盐酸都是一元酸,醋酸是弱酸,盐酸是强酸,硫酸是二元强酸,所以醋酸中存在电离平衡,氯化氢和硫酸完全电离,
①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是b>a=c,
故答案为:b>a=c;
②反应速率与氢离子浓度成正比,开始时这三种溶液中氢离子浓度相等,所以开始反应速率相等,随着反应的进行,醋酸不断电离出氢离子,盐酸和硫酸不再电离出氢离子,所以反应过程中氢离子浓度醋酸最大,硫酸和盐酸中相等,所以反应速率醋酸>硫酸=盐酸,即醋酸用的时间最少,则反应时间a=c>b,
故答案为:a=b=c;a=c>b.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,知道反应过程、稀释构成中醋酸都不断电离出氢离子,反应速率只与氢离子浓度有关,与电解质强弱无关,为易错点,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案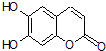 氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 1mol |
| A. | 利用溴单质的氧化性可以把碘离子转化为碘单质 | |
| B. | 实验室常用NaOH溶液吸收多余的Cl2以避免污染 | |
| C. | Cl2不能使有色布条褪色,但Cl2具有氧化性 | |
| D. | 过量的红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl2 |
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R的单质与稀盐酸反应速率L<R | |
| B. | M与T形成的化合物有两性 | |
| C. | Q、T两元素的氢化物分子间都存在氢键 | |
| D. | L、Q形成的简单离子核外电子数相等 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)这些元素的最高价氧化物对应的水化物中酸性最强的是HClO4;能形成两性氢氧化物的元素是Al.
(3)元素的非金属性②大于⑥;氢化物的稳定性⑥小于⑦(填“大于”“小于”或“等于”)
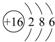
(4)⑥的元素符号为S,原子结构示意图为
(5)④和⑦形成的化合物的电子式为
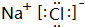 .
.(6)写出④元素单质与水反应的离子方程式2Na+2H2O═2Na++2OH-+H2↑
(7)写出④的最高价氧化物对应的水化物与⑤的最高价氧化对应的水化物反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O.
| A. | NH4Br的电子式:[ ]+Br- ]+Br- | |
| B. | S2-的结构示意图: | |
| C. | 原子核内有18个中子的氯分子:${\;}_{17}^{35}$Cl2 | |
| D. | 水分子的形成过程用电子式表示为:H2+ → → |

 ,B含有的含氧官能团是酯基(写名称).
,B含有的含氧官能团是酯基(写名称). ,D为CH3CH2CH2CHO.
,D为CH3CH2CH2CHO. .
.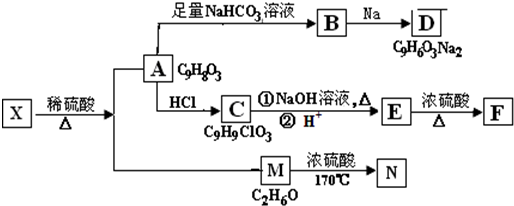
 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.