题目内容
1.生产普通硅酸盐水泥、普通玻璃的主要原料中,共同的是( )| A. | 黏土 | B. | 纯碱 | C. | 石灰石 | D. | 石英(SiO2) |
分析 制取水泥的主要原料为黏土、石灰石、石膏等;光导纤维的主要成分是二氧化硅,生产玻璃的工艺流程解答,主要原料有石灰石、石英和纯碱.据此分析.
解答 解:制取水泥的主要原料为黏土、石灰石、石膏等,生产普通玻璃的主要原料有石灰石、石英和纯碱,生产普通硅酸盐水泥、普通玻璃的主要原料中,共同的是石灰石,
故选C.
点评 本题考查了常见的硅酸盐工业--水泥、玻璃的制备原料,难度不大,加强记忆是关键.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
11.短周期元素A、B、C、D最高价氧化物对应水化物分别为W、X、Y、Z,A是短周期中原子半径最大的元素,常温下W、Y、Z均可与X反应,A、C、D的原子序数及0.1mol/L W、Y、Z溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )

| A. | B的离子半径大于A的离子半径 | |
| B. | C氢化物稳定性大于D氢化物稳定性 | |
| C. | W、Z两物质含有的化学键类型相同 | |
| D. | B原子的电子层数与最外层电子数相等 |
12.在恒容条件下,能使反应NO2 (g)+CO(g)?NO(g)+CO2(g)的反应速率增大且活化分子的百分数也增大的措施是( )
| A. | 增大 NO2或CO的浓度 | B. | 减小 NO或CO2的浓度 | ||
| C. | 通入Ne使气体的压强增大 | D. | 升高反应温度 |
9.设NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标准状况下,2.24LSO3所含分子数为0.1NA | |
| B. | 0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA | |
| C. | 1molNa2O2与足量水反应转移的电子数为NA | |
| D. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
6.中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,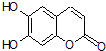 氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
 氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 1mol |
13.如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )


| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
10.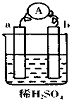 在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述正确的是( )
在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述正确的是( )
 在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述正确的是( )
在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述正确的是( )| A. | 碳棒上有气体放出,溶液pH变小 | B. | a是正极,b是负极 | ||
| C. | 溶液中阳离子移向a极 | D. | a极上发生了氧化反应 |
11.几种短周期元素的原子半径及主要化合价见表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R的单质与稀盐酸反应速率L<R | |
| B. | M与T形成的化合物有两性 | |
| C. | Q、T两元素的氢化物分子间都存在氢键 | |
| D. | L、Q形成的简单离子核外电子数相等 |
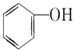 B.
B.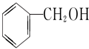 C.甲醇 D.CH3-O-CH3 E.HO-CH2CH2-OH
C.甲醇 D.CH3-O-CH3 E.HO-CH2CH2-OH