题目内容
已知A是短周期主族元素中原子半径最大的元素,由H、C、N三种元素组成的化合物X13.5g在氧气中充分燃烧,生成的气体依次通过足量的无水CaCl2(增重4.5g)、碱石灰(增重22g),由质谱法测得X的相对分子质量为27.请回答:
(1)X的电子式是 .
(2)由A、氢、氮三种元素形成的某化合物M其摩尔质量为39g/mol,与盐酸反应生成两种盐,化合物M所含的化学键有 ,写出物质M投入足量稀盐酸的化学方程式为 .
(3)现有废铜(杂质为一定量的SiO2和单质Fe)来制备胆矾,同时得到副产物Y.有人设计了图1的流程:
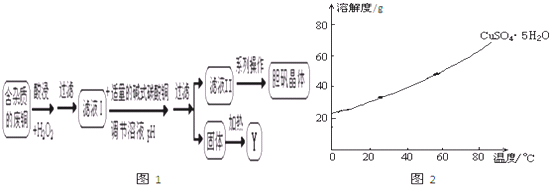
请根据上述流程回答下列问题:
①写出酸浸时生成Cu2+的离子方程式: .
②常温下Ksp[Fe(OH)3]=2.6×10-39,请你计算说明滤液I中加入碱式碳酸铜调节溶液至pH=4时,能否将Fe3+除尽 (一般离子浓度小于10-5mol/L可视作除尽).
③已知胆矾晶体的溶解度曲线图2所示,请问对滤液II进行系列操作的名称依次为蒸发浓缩、 、 、 、晾干.
④请说出Y物质的一种用途 .
(1)X的电子式是
(2)由A、氢、氮三种元素形成的某化合物M其摩尔质量为39g/mol,与盐酸反应生成两种盐,化合物M所含的化学键有
(3)现有废铜(杂质为一定量的SiO2和单质Fe)来制备胆矾,同时得到副产物Y.有人设计了图1的流程:

请根据上述流程回答下列问题:
①写出酸浸时生成Cu2+的离子方程式:
②常温下Ksp[Fe(OH)3]=2.6×10-39,请你计算说明滤液I中加入碱式碳酸铜调节溶液至pH=4时,能否将Fe3+除尽
③已知胆矾晶体的溶解度曲线图2所示,请问对滤液II进行系列操作的名称依次为蒸发浓缩、
④请说出Y物质的一种用途
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题,元素及其化合物
分析:A是短周期主族元素中原子半径最大的元素,则A是Na元素;
由H、C、N三种元素组成的化合物X,由质谱法测得X的相对分子质量为27,根据元素相对原子质量知,X为HCN,13.5g在氧气中充分燃烧,生成的气体依次通过足量的无水CaCl2(增重4.5g)、碱石灰(增重22g),无水氯化钙吸收水分和氨气、碱石灰吸收二氧化碳;
(1)HCN分子中C原子形成四个共价键、N原子形成三个共价且含有一个孤电子对;
(2)由A、氢、氮三种元素形成的某化合物M其摩尔质量为39g/mol,该化合物M的化学式为NaNH2,与盐酸反应生成两种盐NaCl、NH4Cl;
(3)Cu、H2O2在酸性条件下发生反应生成可溶性铜盐和水,铁和双氧水、酸反应生成铁离子,所以滤液I中含有铜离子、铁离子,铜盐溶液和适量的碱式碳酸铜反应并调节溶液的pH得到固体和溶液,采用过滤方法分离,滤液中含有硫酸铜,再采用蒸发浓缩、冷却结晶的方法得到胆矾晶体,沉淀中含有氢氧化铁,加热Fe(OH)3固体得到Fe2O3,从而得到固体Y为Fe2O3.
由H、C、N三种元素组成的化合物X,由质谱法测得X的相对分子质量为27,根据元素相对原子质量知,X为HCN,13.5g在氧气中充分燃烧,生成的气体依次通过足量的无水CaCl2(增重4.5g)、碱石灰(增重22g),无水氯化钙吸收水分和氨气、碱石灰吸收二氧化碳;
(1)HCN分子中C原子形成四个共价键、N原子形成三个共价且含有一个孤电子对;
(2)由A、氢、氮三种元素形成的某化合物M其摩尔质量为39g/mol,该化合物M的化学式为NaNH2,与盐酸反应生成两种盐NaCl、NH4Cl;
(3)Cu、H2O2在酸性条件下发生反应生成可溶性铜盐和水,铁和双氧水、酸反应生成铁离子,所以滤液I中含有铜离子、铁离子,铜盐溶液和适量的碱式碳酸铜反应并调节溶液的pH得到固体和溶液,采用过滤方法分离,滤液中含有硫酸铜,再采用蒸发浓缩、冷却结晶的方法得到胆矾晶体,沉淀中含有氢氧化铁,加热Fe(OH)3固体得到Fe2O3,从而得到固体Y为Fe2O3.
解答:
解:A是短周期主族元素中原子半径最大的元素,则A是Na元素;
由H、C、N三种元素组成的化合物X,由质谱法测得X的相对分子质量为27,根据元素相对原子质量知,X为HCN,13.5g在氧气中充分燃烧,生成的气体依次通过足量的无水CaCl2(增重4.5g)、碱石灰(增重22g),无水氯化钙吸收水分和氨气、碱石灰吸收二氧化碳;
(1)HCN分子中C原子形成四个共价键、N原子形成三个共价且含有一个孤电子对,则HCN的电子式为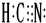 ,故答案为:
,故答案为: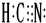 ;
;
(2)由A、氢、氮三种元素形成的某化合物M其摩尔质量为39g/mol,该化合物M的化学式为NaNH2,NaNH2中含有离子键和共价键,与盐酸反应生成两种盐NaCl、NH4Cl,反应方程式为NaNH2+2HCl=NaCl+NH4Cl,故答案为:离子键和共价键;NaNH2+2HCl=NaCl+NH4Cl;
(3)Cu、H2O2在酸性条件下发生反应生成可溶性铜盐和水,铁和双氧水、酸反应生成铁离子,所以滤液I中含有铜离子、铁离子,铜盐溶液和适量的碱式碳酸铜反应并调节溶液的pH得到固体和溶液,采用过滤方法分离,滤液中含有硫酸铜,再采用蒸发浓缩、冷却结晶的方法得到胆矾晶体,沉淀中含有氢氧化铁,加热Fe(OH)3固体得到Fe2O3,从而得到固体Y为Fe2O3,
①酸浸时生成Cu2+的离子方程式为2H++H2O2+Cu=Cu2++2H2O,故答案为:2H++H2O2+Cu=Cu2++2H2O;
②pH=4时,溶液中c(OH-)=10-10mol/L,c(Fe3+)=
mol/L=2.6×10-9mol/L<1×10-5mol/L,则铁离子已经被除尽,
故答案为:pH=4时,溶液中c(OH-)=10-10mol/L,c(Fe3+)=
mol/L=2.6×10-9mol/L<1×10-5mol/L,则铁离子被除尽;
③从硫酸铜溶液中制取硫酸铜晶体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,故答案为:冷却结晶;过滤;洗涤;
④Y为Fe2O3,俗称铁红,可以作炼铁原料或作铁红粉或与铝粉混合可作铝热剂等,
故答案为:炼铁原料或作铁红粉或与铝粉混合可作铝热剂等.
由H、C、N三种元素组成的化合物X,由质谱法测得X的相对分子质量为27,根据元素相对原子质量知,X为HCN,13.5g在氧气中充分燃烧,生成的气体依次通过足量的无水CaCl2(增重4.5g)、碱石灰(增重22g),无水氯化钙吸收水分和氨气、碱石灰吸收二氧化碳;
(1)HCN分子中C原子形成四个共价键、N原子形成三个共价且含有一个孤电子对,则HCN的电子式为
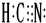 ,故答案为:
,故答案为: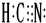 ;
;(2)由A、氢、氮三种元素形成的某化合物M其摩尔质量为39g/mol,该化合物M的化学式为NaNH2,NaNH2中含有离子键和共价键,与盐酸反应生成两种盐NaCl、NH4Cl,反应方程式为NaNH2+2HCl=NaCl+NH4Cl,故答案为:离子键和共价键;NaNH2+2HCl=NaCl+NH4Cl;
(3)Cu、H2O2在酸性条件下发生反应生成可溶性铜盐和水,铁和双氧水、酸反应生成铁离子,所以滤液I中含有铜离子、铁离子,铜盐溶液和适量的碱式碳酸铜反应并调节溶液的pH得到固体和溶液,采用过滤方法分离,滤液中含有硫酸铜,再采用蒸发浓缩、冷却结晶的方法得到胆矾晶体,沉淀中含有氢氧化铁,加热Fe(OH)3固体得到Fe2O3,从而得到固体Y为Fe2O3,
①酸浸时生成Cu2+的离子方程式为2H++H2O2+Cu=Cu2++2H2O,故答案为:2H++H2O2+Cu=Cu2++2H2O;
②pH=4时,溶液中c(OH-)=10-10mol/L,c(Fe3+)=
| 10-39 |
| (10-10)3 |
故答案为:pH=4时,溶液中c(OH-)=10-10mol/L,c(Fe3+)=
| 10-39 |
| (10-10)3 |
③从硫酸铜溶液中制取硫酸铜晶体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,故答案为:冷却结晶;过滤;洗涤;
④Y为Fe2O3,俗称铁红,可以作炼铁原料或作铁红粉或与铝粉混合可作铝热剂等,
故答案为:炼铁原料或作铁红粉或与铝粉混合可作铝热剂等.
点评:本题考查制备实验方案设计,侧重考查物质分离、提纯方法的选取和应用,明确物质的性质是解本题关键,涉及难溶物的溶解平衡、氧化还原反应等知识点,难点是溶度积常数的有关计算,题目难度中等.

练习册系列答案
相关题目
下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A、0.5 mol H2O含有的原子数目为1.5 NA |
| B、32 g O2所含的原子数目为NA |
| C、1 mol H2O含有的H2O分子数目为NA |
| D、0.5 NA个氯气分子的物质的量是0.5 mol |
将NaCl溶液滴在一块光亮的清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.下列说法正确的是( )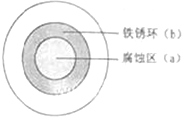

| A、液滴中的Cl-由a 区向b区迁移 |
| B、液滴边缘区发生的电极反应为:2H++2e-=H2 |
| C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a 区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D、导致该现象的主要原因是液滴之下氧气含量比边缘处少. |
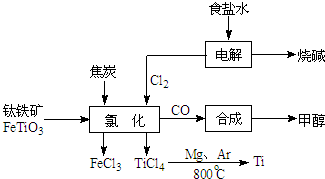
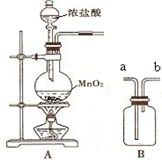 实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题:
实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题: