题目内容
将NaCl溶液滴在一块光亮的清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.下列说法正确的是( )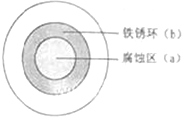

| A、液滴中的Cl-由a 区向b区迁移 |
| B、液滴边缘区发生的电极反应为:2H++2e-=H2 |
| C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a 区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D、导致该现象的主要原因是液滴之下氧气含量比边缘处少. |
考点:原电池和电解池的工作原理
专题:
分析:铁板在氯化钠溶液中发生吸氧腐蚀,属于原电池,a作原电池负极、b作原电池正极,
A、放电时,阴离子向负极移动;
B、液滴边缘是正极区,正极上氧气得电子发生还原反应;
C.铁被腐蚀在负极上发生反应,生锈在正极上反应;
D.a作原电池负极、b作原电池正极,生成的Fe(OH)2被氧化成氢氧化铁.
A、放电时,阴离子向负极移动;
B、液滴边缘是正极区,正极上氧气得电子发生还原反应;
C.铁被腐蚀在负极上发生反应,生锈在正极上反应;
D.a作原电池负极、b作原电池正极,生成的Fe(OH)2被氧化成氢氧化铁.
解答:
解:铁板在氯化钠溶液中发生吸氧腐蚀,属于原电池,a作原电池负极、b作原电池正极,
A.放电时,Cl - 由b区向a区迁移,故A错误;
B.液滴边缘是正极区,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故B错误;
C.液滴下的铁为负极,失电子发生氧化反应而被腐蚀,生成的Fe(OH)2被氧化成氢氧化铁,故C正确;
D.该现象与氧气含量多少无关,故D错误;
故选C.
A.放电时,Cl - 由b区向a区迁移,故A错误;
B.液滴边缘是正极区,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故B错误;
C.液滴下的铁为负极,失电子发生氧化反应而被腐蚀,生成的Fe(OH)2被氧化成氢氧化铁,故C正确;
D.该现象与氧气含量多少无关,故D错误;
故选C.
点评:本题考查金属的吸氧腐蚀,明确各个电极上发生的反应及离子移动方向即可解答,会正确书写电极反应式,知道铁锈的成分,题目难度不大.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、1molNH3所含有的原子数为NA |
| B、常温常压下,22.4L氧气所含的原子数为2NA |
| C、常温常压下,48gO3所含的氧原子数为3NA |
| D、标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
下列说法不正确的是( )
| A、检验食盐中含有钠离子,可以用焰色反应实验,如果焰色呈黄色则可以说明含有钠离子 |
| B、检验食盐中含有氯离子,则可以加用硝酸酸化的硝酸银溶液 |
| C、向溴水中加入食盐溶液,可以使溴水褪色 |
| D、食盐中加碘的作用是预防“大脖子病”的发生 |
氨的催化氧化4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ?mol-1是工业制备硝酸的重要反应.一定条件下将4mol NH3和5mol O2混合并通入固定容积为2L的密闭容器中,经10s该反应达平衡,并测得NO的浓度为0.8mol?L-1.下列判断正确的是( )
| A、以O2浓度变化表示的反应速率为0.064 mol?(L?s)-1 | ||
| B、反应达到平衡状态时NH3的转化率为20% | ||
C、升高温度能使
| ||
| D、将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol?L-1 |
 生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.
生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.