题目内容
1.在极性分子NCl3中,N原子的杂化类型为sp3,该分子中氮元素化合价为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是NH3、HClO(填化学式).分析 根据分子中δ键和孤电子对数判断杂化类型;在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,和水发生水解反应生成氨气和次氯酸.
解答 解:NCl3中含有3个δ键,且孤电子对数为1,所以氮原子的杂化类型为sp3杂化.在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,NCl3发生水解反应生成氨气和次氯酸,所以其产物是NH3、HClO,
故答案为:sp3; NH3、HClO.
点评 本题考查了原子轨道杂化方式及杂化类型的判断,题目较简单,掌握原子轨道的杂化理论是解题的关键.

练习册系列答案
相关题目
11.下列物质中,只含有离子键的是( )
| A. | HCl | B. | KOH | C. | CaCl2 | D. | NH4 NO3 |
12.榄香烯是一种新型的抗癌药,它的结构简式如图,有关说法正确的是( )
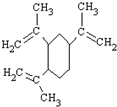

| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 1 mol 榄香烯最多能和3 mol H2反应 | |
| D. | 榄香烯不能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 |
9.下列四组物质的分子式都相同,按物质的分类方法属于同一类物质的是( )
| A. | 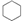 和CH2CH-CH2CH2CH2CH3 和CH2CH-CH2CH2CH2CH3 | B. | 正戊烷和新戊烷 | ||
| C. | CH3-O-CH3和CH3CH2OH | D. | 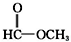 和 和 |
16.下列过程需要吸收热量的是( )
| A. | 甲烷在空气中燃烧 | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | 盐酸与氢氧化钠溶液反应 |
6.元素X原子的最外层有4个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( )
| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | X2Y |
10.下列关于浓HNO3与浓H2SO4的叙述正确的是( )
| A. | 都具有强氧化性 | |
| B. | 在常温下都能与铜反应 | |
| C. | 露置于空气中都能形成白雾 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.