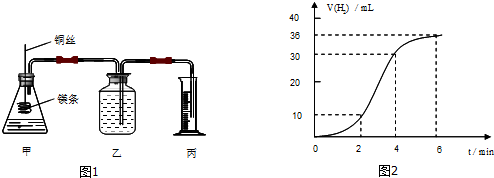
题目内容
18.将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则混合后溶液呈中性,盐酸的体积<氨水的体积(填“>”“=”或“<”).分析 将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),根据电荷守恒判断溶液酸碱性,氯化铵溶液呈酸性,要使混合溶液呈中性,则氨水应该稍微过量.
解答 解:将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),根据电荷守恒得c(H+)=c(OH-),溶液呈中性,氯化铵溶液呈酸性,要使混合溶液呈中性,则氨水应该稍微过量,所以盐酸的体积<氨水的体积,
故答案为:中;<.
点评 本题考查了离子浓度大小比较,题目难度中等,充分考查学生的分析、理解能力及灵活应用能力,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
相关题目
9.下列四组物质的分子式都相同,按物质的分类方法属于同一类物质的是( )
| A. | 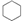 和CH2CH-CH2CH2CH2CH3 和CH2CH-CH2CH2CH2CH3 | B. | 正戊烷和新戊烷 | ||
| C. | CH3-O-CH3和CH3CH2OH | D. | 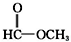 和 和 |
6.元素X原子的最外层有4个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( )
| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | X2Y |
3.下列说法不正确的是( )
| A. | 分子间作用力是分子间相互作用力的总称 | |
| B. | 范德华力与氢键可同时存在于分子之间 | |
| C. | 分子间氢键的形成除使物质的熔沸点升高外,对物质的溶解度、硬度等也有影响 | |
| D. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 |
10.下列关于浓HNO3与浓H2SO4的叙述正确的是( )
| A. | 都具有强氧化性 | |
| B. | 在常温下都能与铜反应 | |
| C. | 露置于空气中都能形成白雾 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
7.下列有关叙述正确的是( )
| A. | 苯分子是碳碳单双键交替相连的结构,因此苯环上碳碳键的键长都不相等 | |
| B. | 苯主要是从石油分馏而获得的一种重要化工原料 | |
| C. |  属于脂环化合物 属于脂环化合物 | |
| D. | 苯是一种无色液体,难溶于水,密度比水小 |
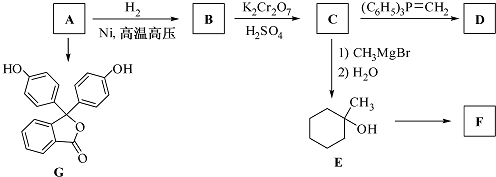
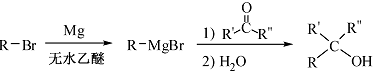
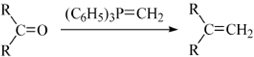
 .
.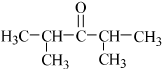 或
或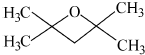 (任写一种).
(任写一种). .
. 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.