题目内容
20.下列说法正确的是( )| A. | 氨水中的溶质是NH3•H2O | |
| B. | NH3有碱性,所以能使湿润的红色石蕊试纸变蓝色 | |
| C. | 所有的铵盐都易溶于水,且受热易分解 | |
| D. | 常温下,浓硫酸、浓硝酸与铁、铝均不反应,所以可用铁制的容器来储存和运输 |
分析 A、氨水溶液中溶质氨气;
B、氨水呈碱性;
C、铵盐都易溶于水,铵盐不稳定受热易分解;
D、浓硫酸、浓硝酸与铁、铝发生钝化,而钝化是化学反应.
解答 解:A、氨水溶液中溶质氨气,而不是一水合氨,故A错误;
B、氨水呈碱性,氨水种的一水合电离产生氢氧根离子,而氨气本身是中性分子,故B错误;
C、铵盐都易溶于水,铵盐不稳定受热易分解,故C正确;
D、浓硫酸、浓硝酸与铁、铝发生钝化,而钝化是化学反应,而不是不反应,故D错误;
故选C.
点评 本题考查了铵盐的性质、氨气的性质,题目难度不大,属于基础性知识的考查,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
8. 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.
Ⅰ.减少二氧化碳的排放是一项重要客题.研究表明,CO2经催化加氢可合成低碳醇.
CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H
几种化学键的键能知表所示
(1)通过计算得出△H=-28kJ/mol.
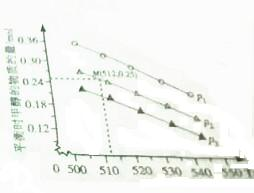
(2)在1.0L恒密闭容器中投入1molCO2和2.75molH2发生该反应,实验测得不同温度压强下,平衡时甲醇的物质的量如图所示.当压强为P2,温度为512K时,向该容器中投入1molCO2、0.5molH2、2molCH2OH、0.6molH2O,平衡向逆方向移动.
(3)以CH3OH、空气(O2含量20%)、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O,用该电池电解500mL1mol/LCuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.Ⅰ.减少二氧化碳的排放是一项重要客题.研究表明,CO2经催化加氢可合成低碳醇.
CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H
几种化学键的键能知表所示
| 化学键 | C=O | H-H | C-C | C-H | O-H | C-O |
| 键能/kJ、mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒密闭容器中投入1molCO2和2.75molH2发生该反应,实验测得不同温度压强下,平衡时甲醇的物质的量如图所示.当压强为P2,温度为512K时,向该容器中投入1molCO2、0.5molH2、2molCH2OH、0.6molH2O,平衡向逆方向移动.
(3)以CH3OH、空气(O2含量20%)、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O,用该电池电解500mL1mol/LCuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
15.下列对有机物结构或性质的描述中错误的是( )
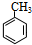
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完成燃烧生成3molH2O | |
| C. | 1-丙醇和2-丙醇的一氯代物种类不同 | |
| D. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 |
12.铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
①铊是易导电的银白色金属
②Tl(OH)3是两性氢氧化物
③Tl3+的氧化能力比Al3+强
④单质能和稀硝酸反应生成硝酸盐.
①铊是易导电的银白色金属
②Tl(OH)3是两性氢氧化物
③Tl3+的氧化能力比Al3+强
④单质能和稀硝酸反应生成硝酸盐.
| A. | ①④ | B. | ②③ | C. | ① | D. | ④ |
10.常温下在下列溶液中加入足量的铁,充分反应后,生成气体最多的是( )
| A. | 20 mL 12 mol/L的盐酸 | B. | 10 mL 18 mol/L的硫酸 | ||
| C. | 80 mL 2 mol/L的硫酸 | D. | 40 mL 14 mol/L的硝酸 |

 ;
;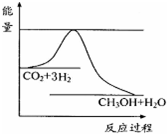 依据事实,写出下列反应的热化学方程式
依据事实,写出下列反应的热化学方程式 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
; ;
;