题目内容
2.下列叙述正确的是( )| A. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| B. | 铜矿石在细菌作用下可直接转化为单质铜,这个过程叫生物炼铜 | |
| C. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| D. | 凯库勒的“基团理论”尽管存在缺陷,但仍对有机化学的发展起到了巨大的推动作用 |
分析 A.相对分子质量在10000以上的分子是高分子化合物;
B.铜矿石在细菌作用下可把不溶性的硫化铜转化为可溶性的铜盐;
C.卤素原子能加速臭氧分解;
D.“基团理论”是李比希提出的.
解答 解:A.相对分子质量在10000以上的分子是高分子化合物,天然高分子化合物有蛋白质、纤维素和淀粉,油脂属于小分子化合物,故A错误;
B.铜矿石在细菌作用下可把不溶性的硫化铜转化为可溶性的铜盐,使铜的冶炼变得简单,故B错误;
C.氟氯烃在大气层中会释放出卤素原子,卤素原子能加速臭氧分解,则氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强,故C正确;
D.“基团理论”是李比希提出的,不是凯库勒,故D错误;
故选C.
点评 本题考查有机物结构和性质、环境污染、金属冶炼等知识点,属于基础题,明确基本概念、基本原理及物质性质是解本题关键,题目难度不大.

练习册系列答案
相关题目
10.镁片和锌片用导线连接后插入稀硫酸中,锌片是( )
| A. | 比镁片活泼 | B. | 电子流出极 | C. | 正极 | D. | 负极 |
10.常温常压下,10mL某气态烃与50mL O2混合点燃并完全燃烧后恢复到原来状况,剩余气体为35mL,则此烃的化学式为( )
| A. | C3H8 | B. | C2H6 | C. | C2H4 | D. | C6H6 |
7.下列实验中,对应的方法或现象以及结论都正确的是( )
| 选项 | 实验 | 方法或现象 | 结论 |
| A | 检查该装置气密性: | 将注射器针管向右拉动一段距离后松手,能够恢复原位 | 气密性良好 |
| B | 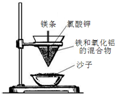 | 点燃镁条后,火花四射,在蒸发皿中产生红热的金属 | 铝热反应: 2Fe+Al2O3$\frac{\underline{\;高温\;}}{\;}$2Al+Fe2O3 |
| C | 将SO2气体通入氢硫酸溶液中 | 有黄色浑浊产生 | 还原性:H2S>SO2 |
| D | 制备CuSO4 | 方法一:用Cu与浓硫酸反应 方法二:用Cu与稀硫酸在不断通入O2的情况下反应 | 方法二更符合绿色化学理念 方法一的原子利用率更高 |
| A. | A | B. | B | C. | C | D. | D |
14.下列实验操作或方案正确的是( )


| A. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液和浓硫酸的洗气瓶 | |
| B. | 用图1所示装置可从KI和I2的固体混合物中回收I2 | |
| C. | 用图2所示装置蒸干FeSO4饱和溶液来制备FeSO4•7H2O | |
| D. | 用图3所示装置除去Cl2中含有的少量HCl |
11.如表关于实验现象的描述正确的是( )
| 选项 | 实验操作 | 实验现象 |
| A | 将盛有CH4与Cl2的集气瓶放在光亮处一段时间 | 气体颜色变浅,瓶内壁附有油状物 |
| B | 将乙烯在空气中点燃 | 火焰呈蓝色并伴有黑烟 |
| C | 向盛有苯的试管中加入几滴酸性KMnO4溶液,充分振荡 | 液体分层,溶液紫色褪去 |
| D | 将蔗糖溶液与稀硫酸混合水浴加热,取反应后的溶液少量,加入几滴新制的Cu(OH)2悬浊液加热 | 出现砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
12.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu、Zn原电池,加快了氢气产生的速率.
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5.
②反应一段时间后,实验E中的金属呈紫红色.
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
| 混合液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu、Zn原电池,加快了氢气产生的速率.
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5.
②反应一段时间后,实验E中的金属呈紫红色.
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.

 .
.