题目内容
5.下列电离方程式书写正确的是( )| A. | Na2SO4═2Na++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaOH═Na++O2-+H+ | D. | H2SO4═H22++SO42- |
分析 A.硫酸钠为强电解质,完全电离;
B.碳酸氢根离子为弱酸的酸式根离子,不能拆;
C.氢氧根离子不能拆;
D.氢离子符号书写错误.
解答 解:A.硫酸钠为强电解质,完全电离,电离方程式:Na2SO4═2Na++SO42-,故A正确;
B.碳酸氢钠为强电解质,完全出钠离子与碳酸氢根离子,电离方程式:NaHCO3═Na++HCO3-,故B错误;
C.氢氧根离子不能拆,氢氧化钠为强电解质完全电离,电离方程式:NaOH═Na++OH-,故C错误;
D.硫酸为强电解质,完全电离,电离方程式:H2SO4═2H++SO42-,故D错误;
故选:A.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度中等.

练习册系列答案
相关题目
15.关于金属钠的说法不正确的是( )
| A. | 钠是银白色固体,质软 | |
| B. | 钠在自然界中既有游离态,又有化合态 | |
| C. | 少量的钠保存在煤油中 | |
| D. | 钠钾合金可以做原子反应堆的导热剂 |
16.下列有关有机化合物组成的叙述正确的是( )
| A. | 所有含碳元素的物质都是有机化合物 | |
| B. | 有机化合物是指所有含碳的化合物 | |
| C. | CO、CO2是含碳化合物,所以它们是有机化合物 | |
| D. | 有机物中一定含碳元素 |
13.设 NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10mL 18mol/L 浓硫酸与足量铜加热充分反应,其中有 0.09NA 个 H2SO4 体现 了氧化性 | |
| B. | 将 5.6g 铁在 3.36LCl2 中点燃,二者一定能恰好完全反应 | |
| C. | 100mL 1mol/L 硫酸溶液中,有 0.1mol H2SO4分子 | |
| D. | 标准状况下,22.4 L CO2和 CO 混合气体中含有的碳原 子数约为 NA |
17.下列有关物质分离,提纯的操作叙述错误的是( )
| A. | 进行蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| B. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 | |
| C. | 1一己醇的沸点比己烷的沸点高,1一己醇和己烷可通过蒸馏初步分离 | |
| D. | 提纯含有少量乙酸的乙酸乙酯;向含有少量乙酸的乙酸乙脂中加入适量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 |
1.室温时,将V mL硫酸铜不饱和溶液蒸发a克水后析出b克CuSO4•5H2O晶体,剩余溶液再蒸发2a克水恰好全部变成c克CuSO4•5H2O晶体,则下列叙述正确的是( )
| A. | 原溶液中含有硫酸铜$\frac{4}{5}$(b+C)g | |
| B. | 原溶液浓度为 $\frac{4(b+C)}{V}$mol/L | |
| C. | 室温时硫酸铜溶解度为$\frac{160C}{50a+9C}$g | |
| D. | 原溶液的溶质质量分数为$\frac{32(b+C)}{3a+b+C}$% |
2.下列溶液中c(Cl-) 与50mL 1mol/L 氯化铝溶液中的c(Cl-) 相等的是( )
| A. | 150 mL 1mol/L氯化钠溶液 | B. | 75 mL 2mol/L氯化铵溶液 | ||
| C. | 150 mL 1mol/L氯化铁溶液 | D. | 75 mL 1mol/L氯化亚铁溶液 |
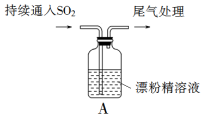 某化学兴趣小组的同学们对SO2通入漂粉精溶液的反应进行实验探究:
某化学兴趣小组的同学们对SO2通入漂粉精溶液的反应进行实验探究: