题目内容
1.在容积固定的密闭容器中发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,容器内部分物质的物质的量浓度如下表:| 时间/浓度 | C(NH3)(mol•L-1) | C(O2)(mol•L-1) | C(NO)(mol•L-1) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
(2)反应在第2min到第4min改变了条件,改变的条件可能是加入催化剂.
分析 (1)反应在第2min到第4min时,NO的平均反应速率=$\frac{(0.5000-0.2000)mol/L}{(4-2)min}$=0.1500mol/(L.min),同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比;
第2min到第4min时,△c(NH3)=(0.8000-0.6000)mol/L=0.2000mol/L,△c(O2)=(1.600-a)mol/L,同一可逆反应同一段时间内各物质的浓度变化量之比等于其计量数之比,所以,△c(NH3):△c(O2)=0.2000mol/L:(1.600-a)mol/L=4:5,a=1.35;
(2)反应在第2min到第4min,△c(NH3)=(0.6000-0.3000)mol/L=0.3000mol/L,0-2min内△c(NH3)=(0.8000-0.6000)mol/L=0.2000mol/L<0.3000mol/L,说明反应速率增大,反应物浓度降低而生成物浓度增大,平衡正向移动.
解答 解:(1)反应在第2min到第4min时,NO的平均反应速率=$\frac{(0.5000-0.2000)mol/L}{(4-2)min}$=0.1500mol/(L.min),同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,所以氧气反应速率=$\frac{0.1500mol/(L.min)}{4}×5$=0.1875mol/(L.min);
第2min到第4min时,△c(NH3)=(0.8000-0.6000)mol/L=0.2000mol/L,△c(O2)=(1.600-a)mol/L,同一可逆反应同一段时间内各物质的浓度变化量之比等于其计量数之比,所以,△c(NH3):△c(O2)=0.2000mol/L:(1.600-a)mol/L=4:5,a=1.35,
故答案为:0.1875;1.35;
(2)反应在第2min到第4min,△c(NH3)=(0.6000-0.3000)mol/L=0.3000mol/L,0-2min内△c(NH3)=(0.8000-0.6000)mol/L=0.2000mol/L<0.3000mol/L,说明反应速率增大,反应物浓度降低而生成物浓度增大,平衡正向移动,改变的条件只能是加入催化剂,故答案为:加入催化剂.
点评 本题考查化学平衡有关计算及化学反应速率影响因素判断,为高频考点,侧重考查学生分析计算能力,利用相同时间内浓度变化量来确定反应速率影响因素,注意:催化剂只影响反应速率但不影响平衡移动.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案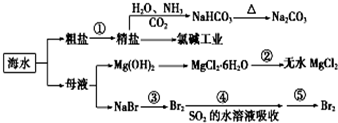
下列有关说法正确的是( )
| A. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上通过电解饱和MgCl2溶液制取金属镁 | |
| C. | 过程②中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| D. | 在③④⑤步骤中,溴元素均被氧化 |
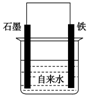 为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )| A. | 正极的电极方程式为:O2+2H2O+4e-═4OH- | |
| B. | 将石墨电极改成Mg电极,难以观察到铁锈生成 | |
| C. | 若向自来水中加入少量NaCl(s),可较快地看到铁锈 | |
| D. | 断开连接石墨和铁的导线,铁便不会生锈 |
| A. | 离子的还原性强弱:I->Fe2+>Cl- | |
| B. | 当a>b时,发生的离子反应:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 当a=b时,发生的离子反应:2I-+Cl2═I2+2Cl- | |
| D. | 当3a≤2b时,发生的离子反应:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- |
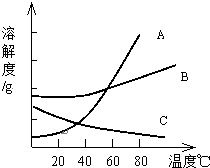 A、B、C三种物质的溶解度曲线如图所示:试回答:
A、B、C三种物质的溶解度曲线如图所示:试回答: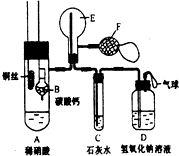 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.  已知Q、R、X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中Q原子外层电子数是内层电子数的两倍;化合物R2Z的晶体为离子晶体,Z原子核外的M层中有两对成对电子;X元素最外层电子数与最内层电子数相同;Y单质的晶体类型在同周期的单质中没有相同的;W元素所在族有三列,只有两个未成对的电子.请根据以上信息,回答下列问题:(答题时,Q、R、X、Y、Z、W用所对应的元素符号表示)
已知Q、R、X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中Q原子外层电子数是内层电子数的两倍;化合物R2Z的晶体为离子晶体,Z原子核外的M层中有两对成对电子;X元素最外层电子数与最内层电子数相同;Y单质的晶体类型在同周期的单质中没有相同的;W元素所在族有三列,只有两个未成对的电子.请根据以上信息,回答下列问题:(答题时,Q、R、X、Y、Z、W用所对应的元素符号表示)