题目内容
7.加热20g碳酸钠和碳酸氢钠的混合物至质量不再减少为止,测的质量为13.8g.求:(1)在标准状况下生成二氧化碳的体积?
(2)混合物中碳酸钠的质量分数是多少?
分析 加热碳酸钠和碳酸氢钠的混合物时,碳酸钠不分解,碳酸氢钠不稳定,加热时分解生成碳酸钠、二氧化碳和水,利用差量法根据2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O计算碳酸氢钠的质量、二氧化碳的物质的量,然后求出碳酸氢钠的物质的量,进而计算碳酸钠的质量分数.
解答 解:加热碳酸钠和碳酸氢钠的混合物时,碳酸钠不分解,碳酸氢钠不稳定,加热时分解生成碳酸钠、二氧化碳和水,发生反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,则固体质量减少的原因是由于碳酸氢钠分解的缘故,设混合物中碳酸氢钠的质量为m,利用差量法计算,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
2×84g 1mol 62g
m n 20g-13.8g=6.2g
则:m=$\frac{84g×2×6.2g}{62g}$=16.8g,
n=$\frac{6.2g×1mol}{62g}$=0.1mol
(1)标准状况下,0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L,
答:在标准状况下生成二氧化碳的体积为2.24L;
(2)混合物中碳酸钠的质量为:20g-16.8g=3.2g,
混合物中碳酸钠的质量分数为:$\frac{3.2g}{20g}$×100%=16%,
答:混合物中碳酸钠的质量分数为16%.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握差量法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| 时间/浓度 | C(NH3)(mol•L-1) | C(O2)(mol•L-1) | C(NO)(mol•L-1) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
(2)反应在第2min到第4min改变了条件,改变的条件可能是加入催化剂.
| A. | 2 | B. | 13 | C. | 1 | D. | 1.3 |
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次减小 | |
| D. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点降低 |
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为akJ,试写出表示甲物质燃烧热的热化学方程式CO(g)+$\frac{1}{2}$O2(g)=CO2 (g);△H=-4a kJ/mol.
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(4)某同学设计了一个以结构简式是BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:

①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;在t2时所得溶液的pH约为1.
请回答下列问题:
(1)划分下列能源的类别,把序号填入相应的表格
①石油 ②地热能 ③沼气 ④风能 ⑤可燃冰
| 类别 | 编号 |
| 新能源 | |
| 常规能源 |
①利用潮汐能发电 ②推广使用乙醇汽油
③用家用汽车代并公交车 ④用节能灯代替白炽灯.
| Fe | Cu | Zn | Ag | Au | W | |
| 熔点/℃ | 1535 | 1083 | 419.5 | 960.8 | 1063 | 3380 |
| 沸点/℃ | 3000 | 2595 | 907 | 2212 | 2707 | 5627 |
| A. | Fe、Ag | B. | Ag、Au | C. | Zn、W | D. | Fe、Au |
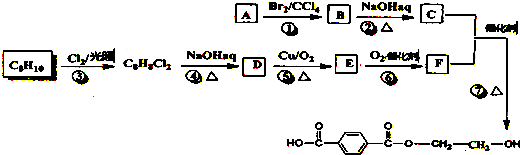
 .
.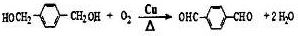
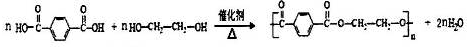
 .
.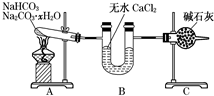 NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).
NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).