题目内容
苯甲酸是重要的酸型食品防腐剂,实验室制备苯甲酸的反应如下,装置示意图如图1:

实验时将一定量的甲苯和KMnO4溶液置于A中,在100℃时,反应一段时间,再停止反应,并按如图2流程分离出苯甲酸和回收未反应的甲苯.
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.17g和6.8 g;回答下列问题:
(1)装置A的名称是 .
(2)装置B的作用是 ,进水口是 (填“a”或“b”).
(3)操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 .
(4)加入少量无水Na2SO4 的目的是 .
(5)若操作Ⅰ后,所得水层呈紫色,要先加足量的亚硫酸氢钾(KHSO4 )溶液,然后再加入浓盐酸酸化,若无此操作会出现的危害是 .
(6)纯度测定:称取1.220 g白色固体B,配成250mL溶液,取其中25.00 mL溶液,进行滴定,消耗KOH物质的量为8×10-4 mol.则产品中苯甲酸质量分数为 .
(7)在操作Ⅲ中,需先蒸发浓缩,再冷却,过滤;如果未冷却即过滤,会使实验的产率偏 (填“高”或“低”),其原因是 .


实验时将一定量的甲苯和KMnO4溶液置于A中,在100℃时,反应一段时间,再停止反应,并按如图2流程分离出苯甲酸和回收未反应的甲苯.
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.17g和6.8 g;回答下列问题:
(1)装置A的名称是
(2)装置B的作用是
(3)操作Ⅰ所需的玻璃仪器有
(4)加入少量无水Na2SO4 的目的是
(5)若操作Ⅰ后,所得水层呈紫色,要先加足量的亚硫酸氢钾(KHSO4 )溶液,然后再加入浓盐酸酸化,若无此操作会出现的危害是
(6)纯度测定:称取1.220 g白色固体B,配成250mL溶液,取其中25.00 mL溶液,进行滴定,消耗KOH物质的量为8×10-4 mol.则产品中苯甲酸质量分数为
(7)在操作Ⅲ中,需先蒸发浓缩,再冷却,过滤;如果未冷却即过滤,会使实验的产率偏
考点:制备实验方案的设计
专题:
分析:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液体采用分液方法分离,根据实验目的知,从而得到有机层和水层,有机层中含有甲苯、水层中含有苯甲酸,有机层中的甲苯采用蒸馏方法得到无色液体A,A是甲苯,将水层盐酸酸化再蒸发浓缩,根据苯甲酸的溶解度知,得到的固体B是苯甲酸,
(1)分析装置图中仪器形状和作用分析名称;
(2)装置B为冷凝管,冷凝效果好水流为逆流;
(3)分离互不相溶的液体采用分液方法,分离互溶且沸点不同的液体采用蒸馏方法;
(4)加入硫酸钠的作用主要是干燥有机层;
(5)如果滤液呈紫色,说明高锰酸钾过量,要先加亚硫酸氢钾,将高锰酸钾还原,否则浓盐酸可能被氧化成氯气;
(6)苯甲酸和KOH溶液发生酸碱中和反应,根据苯甲酸和KOH之间的关系式计算苯甲酸的质量,从而计算苯甲酸的质量分数;
(7)在操作Ⅲ中,需先蒸发浓缩,再冷却,过滤;如果未冷却即过滤,得到固体减少会使实验的产率减小.
(1)分析装置图中仪器形状和作用分析名称;
(2)装置B为冷凝管,冷凝效果好水流为逆流;
(3)分离互不相溶的液体采用分液方法,分离互溶且沸点不同的液体采用蒸馏方法;
(4)加入硫酸钠的作用主要是干燥有机层;
(5)如果滤液呈紫色,说明高锰酸钾过量,要先加亚硫酸氢钾,将高锰酸钾还原,否则浓盐酸可能被氧化成氯气;
(6)苯甲酸和KOH溶液发生酸碱中和反应,根据苯甲酸和KOH之间的关系式计算苯甲酸的质量,从而计算苯甲酸的质量分数;
(7)在操作Ⅲ中,需先蒸发浓缩,再冷却,过滤;如果未冷却即过滤,得到固体减少会使实验的产率减小.
解答:
解:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液体采用分液方法分离,根据实验目的知,从而得到有机层和水层,有机层中含有甲苯、水层中含有苯甲酸,有机层中的甲苯采用蒸馏方法得到无色液体A,A是甲苯,将水层盐酸酸化再蒸发浓缩,根据苯甲酸的溶解度知,得到的固体B是苯甲酸,
(1)分析装置图可知,装置A的名称是:三颈烧瓶,故答案为:三颈烧瓶;
(2)装置B为冷凝管,起到冷凝流出成分的作用,冷凝效果好,水流应为逆流,从a通入;
故答案为:冷凝回流,提高反应物利用率;a;
(3)分离互不相溶的液体采用分液方法,根据流程图中,水层和有机层不互溶,所以可以采用分液方法分离,要用分液漏斗,有机层中物质互溶且沸点不同,所以可以采用蒸馏方法分离,
故答案为:分液漏斗;蒸馏;
(4)加入少量无水Na2SO4 的目的是干燥有机层,故答案为:干燥有机层;
(5)如果滤液呈紫色,说明高锰酸钾过量,要先加亚硫酸氢钾,将高锰酸钾还原,否则浓盐酸可能被氧化成氯气,
故答案为:过量的高锰酸钾氧化盐酸,产生氯气;
(6)设苯甲酸的物质的量浓度为x,则25mL苯甲酸溶液中苯甲酸的物质的量=0.025xmol,
C6H5COOH+KOH→C6H5COOK+H2O
1mol 1mol
0.025xmol 8×10-3mol
1mol:1mol=0.025xmol:8×10-3mol
x=
=0.32mol/L,
则250mL苯甲酸中苯甲酸的质量=0.32mol/L×0.25L×122g/mol=9.76g,
其质量分数=
×100%=80%,
故答案为:80%;
(7)在操作Ⅲ中,需先蒸发浓缩,再冷却,过滤;如果未冷却即过滤,热溶液得到固体减少会使实验的产率减小;
故答案为:低;未冷却固体在热溶液中会溶解造成质量减小.
(1)分析装置图可知,装置A的名称是:三颈烧瓶,故答案为:三颈烧瓶;
(2)装置B为冷凝管,起到冷凝流出成分的作用,冷凝效果好,水流应为逆流,从a通入;
故答案为:冷凝回流,提高反应物利用率;a;
(3)分离互不相溶的液体采用分液方法,根据流程图中,水层和有机层不互溶,所以可以采用分液方法分离,要用分液漏斗,有机层中物质互溶且沸点不同,所以可以采用蒸馏方法分离,
故答案为:分液漏斗;蒸馏;
(4)加入少量无水Na2SO4 的目的是干燥有机层,故答案为:干燥有机层;
(5)如果滤液呈紫色,说明高锰酸钾过量,要先加亚硫酸氢钾,将高锰酸钾还原,否则浓盐酸可能被氧化成氯气,
故答案为:过量的高锰酸钾氧化盐酸,产生氯气;
(6)设苯甲酸的物质的量浓度为x,则25mL苯甲酸溶液中苯甲酸的物质的量=0.025xmol,
C6H5COOH+KOH→C6H5COOK+H2O
1mol 1mol
0.025xmol 8×10-3mol
1mol:1mol=0.025xmol:8×10-3mol
x=
| 8×10-3mol×1mol |
| 1mol×0.025mol |
则250mL苯甲酸中苯甲酸的质量=0.32mol/L×0.25L×122g/mol=9.76g,
其质量分数=
| 9.76g |
| 1.22og |
故答案为:80%;
(7)在操作Ⅲ中,需先蒸发浓缩,再冷却,过滤;如果未冷却即过滤,热溶液得到固体减少会使实验的产率减小;
故答案为:低;未冷却固体在热溶液中会溶解造成质量减小.
点评:本题考查混合物的分离和提纯,侧重考查分析问题能力、计算能力,明确物质的性质是解本题关键,知道根据物质的性质选取合适的分离方法,注意计算浓度得到250ml溶液中溶质物质的量,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关仪器使用方法或实验操作正确的是( )
| A、洗净的锥形瓶和容量瓶可以放进烘箱中烘干 |
| B、用激光笔检验KI溶液中是否溶有淀粉 |
| C、配制硫酸亚铁溶液时,应将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
| D、用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液时,应打开活塞,使乙酸乙酯缓慢流出 |
海水中提取的食盐经精制(除去Ca2+、Mg2+和SO42-)后,含有少量的氯化钾等杂质,为了提纯并得到更多的食盐,用某液体洗涤,该液体最好是( )
| A、蒸馏水 |
| B、饱和食盐水 |
| C、饱和氯化钾溶液 |
| D、75%的酒精溶液 |
常温下,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
| A、9.0 | B、9.5 |
| C、10.5 | D、11.5 |
某有机物 的同分异构体X,X分子中含有苯环,且苯环上一氯代物只有两种,则X的可能结构有( )
的同分异构体X,X分子中含有苯环,且苯环上一氯代物只有两种,则X的可能结构有( )
 的同分异构体X,X分子中含有苯环,且苯环上一氯代物只有两种,则X的可能结构有( )
的同分异构体X,X分子中含有苯环,且苯环上一氯代物只有两种,则X的可能结构有( )| A、3种 | B、4 种 |
| C、5种 | D、6种 |
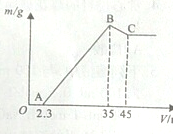 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题:
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题: )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:

 和CH=CHCOOH反应制得,该反应的反应类型是
和CH=CHCOOH反应制得,该反应的反应类型是 )是肉桂酸的同分异构体,下列有关化合物II和肉桂酸的说法正确的是
)是肉桂酸的同分异构体,下列有关化合物II和肉桂酸的说法正确的是 ,它在稀硫酸中能水解,且水解产物经聚合反应后得到高聚物.化合物Ⅲ有多种结构,写出其中一种的结构简式
,它在稀硫酸中能水解,且水解产物经聚合反应后得到高聚物.化合物Ⅲ有多种结构,写出其中一种的结构简式