题目内容
20.间接碘量法测定胆矾中铜含量的原理如下:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:I2+I-→I3-,再用c mol/L Na2S2O3标准溶液滴定:2S2O32-+I3-→S4O62-+3I-.(已知氧化性:Fe3+>Cu2+>I2>FeF63-)准确称取a g胆矾试样(含有少量Fe3+杂质),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL 3mol/L H2SO4溶液,加少量NaF,再加入足量的10% KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入指示剂,用Na2S2O3标准溶液滴定,共用去VmL标准液.(1)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:2Cu2++4I-=2CuI↓+I2.
(2)Cu2+与I-的反应,若酸度太高,则反应速率很慢,但酸度太低也不行.本实验中加入少量硫酸的作用是提供酸性条件,抑制Cu2+的水解.
(3)实验中,在加KI前需加入少量NaF,推测其作用可能是掩蔽Fe3+,防止造成偏大的误差.
(4)本实验中用碘量瓶而不用普通锥形瓶以免反应过程中有空气进入,是因为加盖磨口塞可防止空气进入锥形瓶氧化I-,影响I2的量的测定,若用普通锥形瓶进行该实验,则测定结果偏低(选填“偏高”、“偏低”、“不受影响”).
(5)滴定实验中所用的指示剂为淀粉溶液,判定滴定终点的现象是当加入最后一滴Na2S2O3标准溶液时,锥形瓶中溶液恰好由蓝色转变为无色且半分钟不变化.根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=$\frac{64cV}{10a}$%.
分析 (1)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(CuI)并析出碘,配平书写离子方程式;
(2)Cu2+能发生水解反应溶液呈酸性,加入硫酸可抑制水解;
(3)胆矾加酸溶解后溶液中含有Fe3+,Fe3+能氧化I-生成I2,Fe3+的存在影响Cu2+的测定;
(4)氧气能将碘离子氧化为碘单质,影响Cu2+的测定;
(5)碘单质遇到淀粉变蓝色,随硫代硫酸钠溶液滴入,碘单质反应完全后,溶液蓝色变为无色;
根据关系式:2Cu2+~I2~I3-~2S2O32-计算出Cu2+的质量,再用Cu2+的质量除以样品质量即可.
解答 解:(1)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,离子方程式为:2Cu2++4I-=2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2;
(2)Cu2+能发生水解反应溶液呈酸性,提供酸性条件,抑制Cu2+的水解,
故答案为:提供酸性条件,抑制Cu2+的水解;
(3)胆矾加酸溶解后溶液中含有Fe3+,Fe3+能氧化I-生成I2,造成Cu的质量偏大,影响测定结果,加入少量NaF,发生反应Fe3++6F-=[FeF6]3-,FeF63-不能氧化I-,
故答案为:掩蔽Fe3+,防止造成偏大的误差;
(4)用碘量瓶溶液不与空气中氧气接触,而用普通锥形瓶能与空气中氧气接触,氧气能与碘化钾反应生成单质碘,导致消耗Na2S2O3标准溶液偏小,测定Cu元素质量分数偏低,所以用碘量瓶防止空气中的氧气与碘化钾反应,影响I2的量的测定,
故答案为:加盖磨口塞可防止空气进入锥形瓶氧化I-,影响I2的量的测定;偏低;
(5)滴定实验是用Na2S2O3标准溶液滴定反应生成的碘单质,碘单质遇淀粉溶液变蓝色,选择滴定指示剂为淀粉,滴定终点判断为:当加入最后一滴Na2S2O3标准溶液时,锥形瓶中溶液恰好由蓝色转变为无色且半分钟不变化即到达滴定终点,
故答案为:淀粉溶液;当加入最后一滴Na2S2O3标准溶液时,锥形瓶中溶液恰好由蓝色转变为无色且半分钟不变化;
Na2S2O3标准溶液的物质的量为cmol/L×V×10-3L,由关系式:2Cu2+~I2~I3-~2S2O32-,可知Cu2+的物质的量为cmol/L×V×10-3L,Cu2+的质量为:cmol/L×V×10-3L×64g/mol,所以ω(Cu)=$\frac{cmol/L×V×1{0}^{-3}L×64g/mol}{ag}$×100%=$\frac{64cV}{10a}$%,
故答案为:$\frac{64cV}{10a}$%.
点评 本题考查物质的含量的测定,涉及氧化还原反应滴定应用,侧重于学生实验能力和分析能力的考查,注意利用关系式法解答,题目难度中等.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 2NO(g)+O2(g)═2NO2(g) | B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g) | ||
| C. | NH4NO3(s)═NH4+(aq)+NO3-(aq) | D. | H2(g)+Cl2(g)═2HCl(l) |
| A. | b+n | B. | b+a+n | C. | b+a-n | D. | b-a+n |
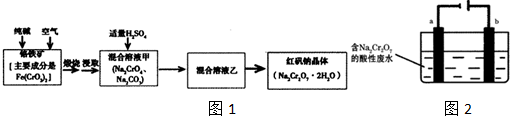
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下: 双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯.BPA的结构简式如图所示.
双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯.BPA的结构简式如图所示.
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.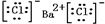 ,⑤的电子式是
,⑤的电子式是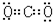 .
.