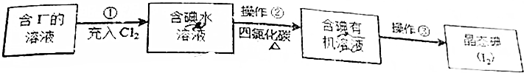
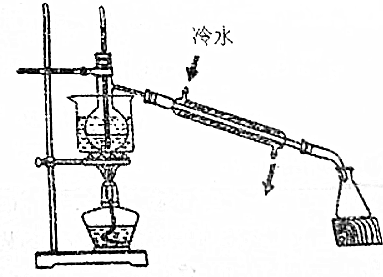
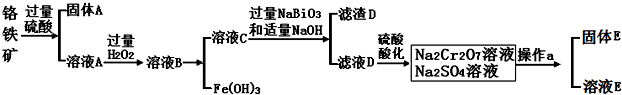
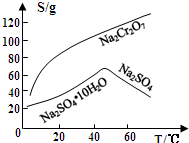
题目内容
20.下列有关实验现象的描述中,正确的是( )| A. | 向氯化亚铁溶液中加入氢氧化钠溶液,先有白出现,后白色沉淀逐渐消失 | |
| B. | 将铜片放人氯化铁溶液,钢片表面生成银白色的铁 | |
| C. | 在氯化铁溶液中滴入氢氧化钠溶液,有红褐色沉淀出现 | |
| D. | 将铜粉加人冷的浓硝酸中会发生钝化 |
分析 A.亚铁离子与氢氧化钠反应生成白色的氢氧化亚铁沉淀,氢氧化亚铁很快被氧化,溶液变成灰绿色,最终变为红褐色;
B.铜的金属活动性小于铁,不能置换金属铁;
C.在氯化铁溶液中滴入氢氧化钠溶液发生复分解反应生成氢氧化铁红褐色沉淀;
D.铜和浓硝酸能发生反应生成二氧化氮、硝酸铜和水.
解答 解:A.氯化亚铁溶液中加入NaOH溶液后,发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,反应过程中出现的现象为:先生成白色沉淀,白色沉淀迅速经灰绿色并转化为红褐色沉淀,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故A错误;
B.把铜片插入三氯化铁溶液中,铜和氯化铁反应生成氯化铜和氯化亚铁,2FeCl3+Cu=2FeCl2+CuCl2,铜的金属活动性不及铁,铜不能置换出铁,故B错误;
C.在氯化铁溶液中滴入氢氧化钠溶液发生复分解反应生成氢氧化铁红褐色沉淀,FeCl3+3NaOH=Fe(OH)3↓+3NaCl,故C正确;
D.铜和浓硝酸能发生反应生成二氧化氮、硝酸铜和水,在冷的浓硝酸中不会发生钝化现象,是铁、铝在冷的浓硝酸中发生钝化,故D错误;
故选C.
点评 本题考查了铁、氯化铁、氢氧化亚铁、氢氧化铁的性质,题目难度不大,注意掌握氯化亚铁的制备方法,氯化铁溶液的氧化性,氢氧化铁和氢氧化亚铁的颜色变化,能够正确判断反应的现象和反应实质是解题关键.

练习册系列答案
相关题目
11.NA代表阿伏伽德罗常数.已知C2H4和C3H6的混合物的质量为ag,则该混合物( )
| A. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 常温常压,完全燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | |
| C. | 所含共用电子对数目为($\frac{a}{7+1}$)NA | |
| D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
8.在CO2的水溶液中,H2CO3达到电离平衡的标志是( )
| A. | c(HCO3-)=c(CO32-) | B. | 溶液中无H2CO3 | ||
| C. | c(HCO3-)恒定不变 | D. | 溶液中H2CO3、HCO3-、CO32-共存 |
15.已知在0.1mol•L-1的CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+,下列叙述正确的是( )
| 选项 | 改变条件 | 平衡移动方向 | 导电能力 |
| A | 加入蒸馏水 | 逆向移动 | 减弱 |
| B | 加入少量冰醋酸 | 正向移动 | 增强 |
| C | 加入少量CH3COONa固体 | 正向移动 | 增强 |
| D | 加入少量0.1mol•L-1的稀硫酸 | 逆向移动 | 减弱 |
| A. | A | B. | B | C. | C | D. | D |
5.等体积的pH=12的碱溶液甲和pH=11的碱溶液乙,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,下列判断合理的是( )
| A. | 乙一定是弱碱 | B. | 甲一定是强碱 | C. | 乙一定是二元碱 | D. | 甲一定是一元碱 |